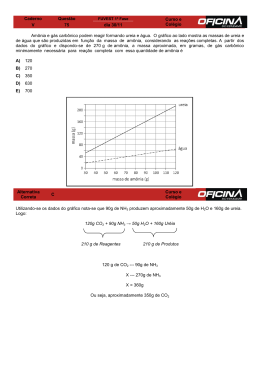
PAAES 2011-2014 1ª ETAPA Às 17h do dia 22 de abril de 1915, durante a I Guerra Mundial, as tropas alemãs na cidade de Ypres, na França, descarregaram 180.000 kg de cloro gasoso (Cl2) contidos em 5.730 cilindros na região de Steenstraat no canal de Yser e Poelcappelle. O chefe do serviço de guerra química alemã, o Prof. Fritz Haber, dirigiu pessoalmente esse ataque. Quatro anos mais tarde, em 1918, ganhou o prêmio Nobel em química por sua descoberta de um processo para sintetizar amônia (NH3) pela combinação de nitrogênio (N2) e hidrogênio (H2). Fonte: Domingos, J. B. Armas químicas. Disponível em: http://www.qmc.ufsc.br.Acesso em 11 de setembro de 2011. Sobre as substâncias destacadas no texto, marque, para as alternativas abaixo, (V) Verdadeira, (F) Falsa ou (SO) Sem Opção. 1 - ( ) 2 - ( ) 3 - ( ) 4 - ( ) O cloro gasoso é formado pela combinação química de átomos de cloro unidos por ligação covalente. A amônia é uma substância apolar gasosa que forma entre si fracas interações. Os coeficientes estequiométricos da reação de formação da amônia, a partir de gás nitrogênio e hidrogênio, é 1, 3, 2. Os átomos de nitrogênio possuem entre si triplas ligações. Resolução: 1 - (V) 2 - (F) 3 - (V) 4 - (V) Verdadeiro, pois por definição temos que ligação covalente é a ligação queocorre o compartilhamento de elétrons. A molécula de cloro é formado por compartilhamento de um par de elétrons por dois átomos de cloro. A geometria molecular da amônia épiramidal (teoria da repulsão dos pares eletrônicos), sendo assim uma molécula polar. As moléculas de NH3 apresentam interação intermolecular do tipo ligação de hidrogênio que são interações fortes. Ao balancear-se a equação tem-se: 1N2(g) + 3H2(g) 2NH3(g) O átomo de nitrogênio possui 5 elétrons na camada de valência. Pela regra do octeto, sabe-se que o nitrogênio necessita de 8 elétrons para adquirir estabilidade eletrônica, necessitando portanto efetuar 3 covalências, o que caracteriza a tripla ligação.. Q U Í M I C A
Download