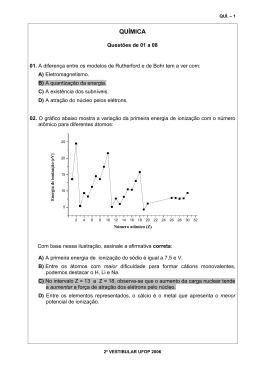
Tabela Periódica* 18 Número atômico 1 1 2 3 2º VESTIBULAR UFOP 2006 4 5 6 7 H 1 2 H 1,0 2 3 4 Li Be B C N 6,9 9,0 10,8 12,0 14,0 11 12 13 14 15 Na Mg 4 5 6 7 8 9 10 11 12 Si 24,3 3 Al 23,0 27,0 28,1 19 20 21 22 23 24 25 26 27 28 29 30 31 32 1,0 Massa atômica He 13 14 15 16 17 5 6 7 8 9 10 O F Ne 16,0 19,0 20,2 16 17 18 P S Cl Ar 31,0 32,1 35,5 39,9 33 34 35 36 4,0 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39,1 40,1 45,0 47,9 50,9 52,0 54,9 55,8 58,9 58,7 63,5 65,4 69,7 72,6 74,9 79,0 79,9 83,8 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85,5 87,6 88,9 91,2 92,9 95,9 (97) 101,1 102,9 106,4 107,9 112,4 114,8 118,7 121,8 127,6 126,9 131,3 55 56 57 74 75 76 77 78 79 80 81 82 83 84 85 86 72 73 Cs Ba † La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132,9 137,3 138,9 178,5 180,9 183,8 186,2 190,2 192,2 195,1 197,0 200,6 204,4 207,2 209,0 (209) (210) (222) 87 88 89 104 105 106 107 108 109 68 69 70 71 Fr Ra (223) (226) † ‡ ‡ Ac Rf Db Sg Bh Hs Mt (227) (261) (262) (263) (262) (265) (266) 58 59 60 61 62 63 64 65 66 67 Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 140,1 140,9 144,2 (145) 150,4 152,0 157,3 158,9 162,5 164,9 167,3 168,9 173,0 175,0 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Th Pa U Np Pu Cf Es Fm Md No Lr 232,0 (231) 238,0 (237) (242) (251) (252) (257) (259) (260) Am Cm Bk (243) (247) (247) (258) * Nova numeração dos grupos, segundo recomendação da IUPAC de 1990. Símbolos dos elementos 104 a 109 de acordo com recomendação da IUPAC de 1997. QUÍ. – 9 Ce GRUPO 1 1 QUÍ. – 10 GRUPO 1 QUÍMICA Questões de 01 a 04 01. Comercialmente, a pureza de um objeto de ouro é indicada em quilates, sendo que 1 quilate corresponde a 1/24 da massa do objeto em ouro. O ouro pode ser solubilizado em uma mistura ácida, denominada de água régia, conforme a seguinte equação não-balanceada: Au(s) + 3HNO3(aq) + 4HCl(aq) → HAuCl4(aq) + 3H2O(l) + 3NO2(g) A) Determine o número de átomos de ouro contidos em uma aliança de 2,63 g, sendo que o teor de ouro é de 18 quilates. 24 quilates – 2,63g Xg= 1,97 de ouro 18 quilates – Xg 6,02 ⋅ 10²³ átomos – 197g de ouro Y= 6,02 ⋅ 10²¹ átomos de ouro Y – 1,97g B) Determine o volume de NO2(g) produzido na CNTP quando a massa de ouro contida na aliança, referida no item anterior, é dissolvida em água régia. 197g de ouro – 3x22,4 litros 1,97g de ouro – X litros de NO2 X= 0,67 litros de NO2 02. Abaixo encontram-se representadas as estruturas de alguns compostos orgânicos. O CH3 O OH CH3CH2OH ClCH2 OH CH3CH2NH2 I II III IV Considerando que a acidez desses compostos pode ser avaliada pela habilidade dos mesmos em ceder um próton (H+) para uma base, responda: A) Qual desses compostos é o menos ácido? Justifique a sua escolha. IV. A ligação N-H é a menos polarizada ou N é o menos eletronegativo. B) Qual desses compostos é o mais ácido? III C) Indique a fórmula estrutural da base conjugada do composto I. 2º VESTIBULAR UFOP 2006 QUÍ. – 11 GRUPO 1 03. O gráfico abaixo refere-se à variação de energia de uma reação hipotética, ocorrendo no sentido direto, em duas etapas. Energia Potencial (kJ) 1ª Etapa 2ª Etapa 60 50 40 30 5 Caminho da reação A) Qual das duas etapas é determinante da velocidade da reação hipotética global? Justifique. A etapa determinante é a etapa mais lenta, ou seja, a que tem maior energia de ativação. Portanto, a etapa determinante da reação é a primeira. B) Calcule o calor de reação, ∆H, correspondente à etapa mais endotérmica da reação hipotética global. ∆H = 30 − 5 = 25KJ C) Calcule o calor de reação, ∆H, correspondente à reação hipotética global inversa. ∆H = 5 − 40 = −35 KJ 2º VESTIBULAR UFOP 2006 QUÍ. – 12 GRUPO 1 Pressão (mm Hg) 04. Considere o gráfico a seguir, que mostra a variação da pressão de vapor de dois líquidos, A e B, com a temperatura. Temperatura (°C) A) Qual é a pressão de vapor do líquido A a 70°C? 700mm Hg B) A que temperatura o líquido B tem a mesma pressão de vapor do líquido A a 70°C? 115°C C) Explique, com base nas forças intermoleculares, qual dos dois líquidos é o mais volátil. O líquido A é mais volátil, pois tem maior pressão de vapor em todas as temperaturas. A pressão de vapor maior significa que as forças intermoleculares são fracas, permitindo que o líquido evapore mais facilmente. D) Proponha um método para se abaixar a pressão de vapor de um líquido, sem reduzir a sua temperatura. - Adição de soluto não volátil ou - Diminuição da pressão sobre o líquido ou - Colocar o líquido em um local de maior altitude. 2º VESTIBULAR UFOP 2006
Download