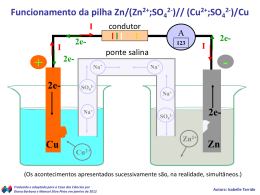
Ciências da Natureza e suas Tecnologias - Química Ensino Médio, 3ª Série Potencial das pilhas QUÍMICA, 3º Ano Potencial das Pilhas No nosso cotidiano usamos ... Imagens : (A) Arpingstone/Domínio público / (B) M.Minderhoud/ GNU Free Documentation License / (C) Christian Rasmussen/ Creative Commons Atribuição - Partilha nos Mesmos Termos 3.0 Não Adaptada / (D) Valter Campanato/ABr / Creative Commons Atribuição 3.0 Brasil / (E) Matias.Reccius/Domínio Público / (F) CHG/Domínio público QUÍMICA, 3º Ano Potencial das Pilhas Para que isto seja possível necessitamos de ENERGIA O que é ENERGIA ELÉTRICA? ENERGIA ELÉTRICA é uma forma de energia baseada na geração de diferença de potencial elétrico entre dois pontos que permitem estabelecer uma corrente elétrica entre ambos. ELÉTRICA QUÍMICA, 3º Ano Potencial das Pilhas A energia elétrica é obtida principalmente através de ... Imagens : (A) Angeloleithold 2005/Disponibilizada por Massimiliano W/ Creative Commons - Atribuição - Partilha nos Mesmos Termos 3.0 Não Adaptada / (B) Fernando Tomás de Zaragoza, Spain / Disponibilizada por FlickrLickr/ Creative Commons - Atribuição 2.0 Genérica / (C) Wagner Christian/ Creative Commons - Atribuição - Partilha nos Mesmos Termos 2.5 Genérica; (D) Marcus Wong Wongm/ GNU Free Documentation License (E) Cyberpunk/Creative Commons - CC0 1.0 Universal (CC0 1.0) Dedicação ao Domínio Público QUÍMICA, 3º Ano Potencial das Pilhas A Química contribui com alguns fenômenos relacionados com a energia elétrica... REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Imagens : (A) Aney/GNU Free Documentation License / (B) Shaddack/Public Domain / (C) Mbarousse/Public Domain QUÍMICA, 3º Ano Potencial das Pilhas Um pouco de História Imagem : Autor desconhecido/Disponibilizada por Tomisti/Domínio Público Tales de Mileto, ao esfregar âmbar na pele de carneiro, observou que pedaços de palha eram atraídos pelo âmbar. QUÍMICA, 3º Ano Potencial das Pilhas Luigi Aloisio Galvani Imagem : Autor desconhecido/ Disponibilizada por Kelson/Domínio Público publicou pesquisa onde concluía que os músculos armazenavam eletricidade e os nervos conduziam essa eletricidade. QUÍMICA, 3º Ano Potencial das Pilhas Imagens :(A) Bcrowell/United States Public Domain / (B) GuidoB/GNU Free Documentation License Alessandro Volta produziu a primeira pilha elétrica do mundo. Ela era composta de uma série de discos de prata e zinco, colocados em pares e intercalados com folhas de papelão saturadas em água e sal. QUÍMICA, 3º Ano Potencial das Pilhas A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA Quando uma corrente elétrica provoca uma reação química teremos uma ELETRÓLISE Imagem : Lukas A, CZE / Public Domain QUÍMICA, 3º Ano Potencial das Pilhas PILHA DE DANIELL Esta pilha baseia-se na seguinte reação: Zn + CuSO4 Cu + ZnSO4 ou, na forma iônica ** Zn + Cu2+ Cu + Zn2+ ELÉTRONS DANIELL percebeu que estes elétrons poderiam ser transferidos do Zn para os íons Cu2+ por um fio condutor externo e que este movimento produzia uma Imagem : Mbarousse/Public Domain QUÍMICA, 3º Ano Potencial das Pilhas E isto seria possível montando um esquema do tipo representado a seguir: ELÉTRONS ELÉTRONS Voltímetro CÁTIONS ÂNIONS Zn Cu PONTE SALINA Zn2+ Zn2+ Zn2+ Zn2+ Cu2+ Cu2+ Cu2+ Cu2+ QUÍMICA, 3º Ano Potencial das Pilhas Com o tempo teremos ... eletrodo aonde chega ossua elétrons éaumentada oconcentrada POLO POSITIVO DA PILHA O O solução A eletrodode de sulfato ZINCO COBRE de sofre tem zinco cobre corrosão fica fica massa mais mais diluída ELÉTRONS ELÉTRONS ÂNIONS Zn Voltímetro CÁTIONS Cu PONTE SALINA + – Zn2+ Zn2+ Zn2+ Cu2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Zn2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ QUÍMICA, 3º Ano Potencial das Pilhas REPRESENTAÇÃO DE UMA PILHA Uma pilha, segundo a IUPAC, deve ser representada da seguinte forma: Para a pilha de DANIELL 0 M1 Zn0 x+ M1 Zn2+ POLONEGATIVO NEGATIVO POLO OXIDAÇÃO OXIDAÇÃO ÂNODO ÂNODO y+ M2 Cu2+ 0 M2 Cu0 POLOPOSITIVO POSITIVO POLO REDUÇÃO REDUÇÃO CÁTODO CÁTODO QUÍMICA, 3º Ano Potencial das Pilhas 01) As relações existentes entre os fenômenos elétricos e as reações químicas são estudadas: a) na termoquímica. b) na eletroquímica. c) na cinética química. d) no equilíbrio químico. e) na ebuliometria. QUÍMICA, 3º Ano Potencial das Pilhas 02) Observando a pilha abaixo, responda: Co Co2+ Au3+ Au a) Quais as semirreações? Co – 2 e Au3+ + 3 e - Co2+ semirreação de oxidação Au semirreação de redução b) Qual a reação global? 3 Co 2e – 6 2 Au3+ + 3 6 e3 Co + 2 Au3+ 3 Co2+ 2 Au 3 Co2+ + 2 Au (reação global) QUÍMICA, 3º Ano Potencial das Pilhas Co Co2+ Au3+ Au c) Quem sofre oxidação? Co d) Quem sofre redução? Au3+ e) Qual o eletrodo positivo ou cátodo? Au f) Qual o eletrodo negativo ou ânodo? Co g) Que eletrodo será gasto? Co h) Qual dos eletrodos terá a sua massa aumentada? Au QUÍMICA, 3º Ano Potencial das Pilhas 03) O esquema abaixo ilustra uma cela galvânica (pilha), ressaltando o sentido de movimentação dos elétrons. ELÉTRONS ELÉTRONS Voltímetro Zn Ni PONTE SALINA Ni2+ Zn2+ Zn2+ Zn2+ Ni2+ Ni2+ Zn2+ Ni2+ Sobre essa pilha, responda às questões: h) c) d) e) g) f) Equacione Qual a é a espécie placa a reação semi-reação queque em química sofre se deposita anódica que catódica da sofre pilha sólido? oxidação? E a que sofre redução? a) b) dos eletrodos églobal o corrosão? ânodo? polo negativo? Qual é oE cátodo? o positivo? 00 – Zn –– 022 ee 0 –– 0 Zn 2+ Oxidação: Placa de Ni Zn Ni negativo: + Zn Placa Ânodo: Polo de Zn 2 e Zn 2+ Ni + 2e– Zn0 + Ni2+ Zn2+ + 2+ 2+ Zn Zn 0 0 2+ Redução: Ni Cátodo: Polo NiNi positivo: Ni0 Ni0 Ni0 QUÍMICA, 3º Ano Potencial das Pilhas 04) (Covest) Podemos dizer que, na célula eletroquímica Mg(s) / Mg2+(aq) // Fe2+(aq) / Fe(s): a) o magnésio sofre redução. b) o ferro é o ânodo. c) os elétrons fluem, pelo circuito externo, do magnésio para o ferro. d) há dissolução do eletrodo de ferro. e) a concentração da solução de Mg2+ diminui com o tempo. QUÍMICA, 3º Ano Potencial das Pilhas 05) O polo de onde saem os elétrons, em uma pilha, é: a) cátodo. b) polo positivo. c) ânodo. d) o eletrodo que aumenta a massa. e) o que ocorre redução. QUÍMICA, 3º Ano Potencial das Pilhas Os metais que fazem parte de uma reação de óxido-redução têm uma tendência a CEDER ou RECEBER ELÉTRONS Essa tendência é determinada pelo potencial de eletrodo (E), medido em volts (V) QUÍMICA, 3º Ano Potencial das Pilhas Quanto maior for a medida do potencial de oxidação, maior é a tendência do metal ceder elétrons Quanto maior for a medida do potencial de redução, maior é a tendência do metal ganhar elétrons QUÍMICA, 3º Ano Potencial das Pilhas Este potencial, em geral, é medido a 1 atm, 25°C e solução 1 mol/L Sendo assim, nestas condições, chamado de POTENCIAL NORMAL DE ELETRODO (E°) Esse potencial é medido tomando-se como referencial um eletrodo de hidrogênio, que tem a ele atribuído o potencial “0,00 V” QUÍMICA, 3º Ano Potencial das Pilhas Oxidante F2 S2 MnO4MnO4Au3+ PbO2 Cl2 (aq) Cr2O72O2 (g) Br2 NO3Ag+ Fe3+ I2 (aq) Cu2+ CH3CHO SO42S4O62H3O+ CH3CO2H Pb2+ Sn2+ Ni2+ Cd2+ Fe2+ Zn2+ Al3+ Mg2+ K+ Li+ E0 (V) +2.87 +2.10 +1.69 +1.51 +1.50 +1.45 +1.39 +1.33 +1.23 +1.07 +0.96 +0.80 +0.77 +0.62 +0.34 +0.19 +0.17 +0.09 0.00 -0.12 -0.13 -0.14 -0.23 -0.40 -0.44 -0.76 -1.66 -2.37 -2.92 -3.02 Redutor FSO42MnO2 Mn2+ Au Pb2+ ClCr3+ H2O BrNO(g) Ag Fe2+ ICu CH3CH2OH SO2 S2O32H2 (g) CH3CHO Pb Sn Ni Cd Fe Zn Al Mg K Li Potencial – padrão da semicela QUÍMICA, 3º Ano Potencial das Pilhas Para a pilha de Daniell os potenciais são: Zn2+ + 2e Cu2+ + 2e – – Zn E°red = – 0,76 V Cu E°red = + 0,34 V Como o cobre tem um maior potencial normal de redução ele vai ganhar elétrons, sofrendo redução, e o zinco vai perder elétrons, sofrendo oxidação Cu2+ + 2 e Zn Zn + Cu2+ Cu – Zn2+ + 2 e– Zn2+ + Cu E°red = + 0,34 V E°oxi = + 0,76 V ΔE = + 1,10 V QUÍMICA, 3º Ano Potencial das Pilhas 01) As seguintes semicelas são usadas para montar uma pilha: Considerando os potenciais de semicela: Zn Ag Zn2+ Ag+ Zn2+ Ag + (aq) (aq) (s) – Zn (s) E = – 0,76 V + 1e – Ag (s) E = + 0,80 V Ag+ ∆E0 para essa pilha Zn (s) 2+ (aq) + 2e + 2 Ag + (aq) Zn 2+ (aq) E = + 0,76 V – + + – –Ag 2 AgAg ee 2 Ag (aq) (aq)+ +1 2 (s) Zn + 2e Ag+ i) Calcule o valor do Zn 2+ Ag+ Zn2+ Zn2+ Zn (s) E = + 0,80 V + 2 Ag (s) ∆E = + 1,56 V QUÍMICA, 3º Ano Potencial das Pilhas 02) Conhecendo as seguintes semirreações e os seus potenciais padrão de redução abaixo, determine a “ d.d.p “ da pilha formada pelos eletrodos indicados: Sn2+ + 2e Ag1+ + 1e a) + 0,54 V. – Sn E° = – 0,14 V Ag E° = + 0,80 V O potencial de redução da prata b) + 0,66 V. é maior que o do estanho c) + 1,46 V. d) + 0,94 V. – A prata sofre redução e o estanho sofre oxidação e) + 1,74 V. 2 Ag1+ Sn 1e + 2 2 Ag – Sn2+ + 2e – E° = + 0,80 V E° = + 0,14 V ∆E = + 0,94 V QUÍMICA, 3º Ano Potencial das Pilhas 03) Considere as seguintes semirreações e os potenciais normais de redução: Ni 2+ + 2 e– Ni E 0 = – 0,25 V Au 3+ + 3 e– Au E 0 = + 1,50 V O potencial da pilha formada pela junção dessas duas semirreações é: a) + 1,25 V. b) – 1,25 V. c) + 1,75 V. d) – 1,75 V. e) + 3,75 V. 2 Au 3 Ni 2 Au 3+ 3+ 6e – +3 2 Au 3 Ni 2+ 6 e– + 2 + 3 Ni 2 Au + 3 Ni +2 E 0 = + 1,50 V E 0 = + 0,25 V ∆E 0 = + 1,75 V QUÍMICA, 3º Ano Potencial das Pilhas O que você faz com suas pilhas usadas? Imagem : Brianiac/Public Domain QUÍMICA, 3º Ano Potencial das Pilhas Se você descarta materiais desse tipo no lixo comum, Imagem : Victorgrigas/Creative Commons Attribution-Share Alike 3.0 Unported coloca a própria saúde e a de outras pessoas em risco com a contaminação do solo e das águas com metais pesados. QUÍMICA, 3º Ano Potencial das Pilhas Faça a Reciclagem das Pilhas Imagem : Krdan/Public Domain Os fabricantes e os importadores são os responsáveis pela reutilização, reciclagem, tratamento ou disposição final do produto. QUÍMICA, 3º Ano Potencial das Pilhas Procure saber mais sobre: Por que reciclar pilhas e baterias? Riscos ao meio ambiente e à saúde dos constituintes de uma pilha. Dicas sobre o uso correto de pilhas e baterias Referências http://www.mundociencia.com.br/fisica/eletricidade/historiaeletricidade.htm http://www.ebah.com.br/content/ABAAABXiYAF/eletroquimica Tabela de Imagens n° do slide 2A 2B 2C 2D 2E 2F 4A 4B direito da imagem como está ao lado da foto Arpingstone/Domínio público link do site onde se consegiu a informação Data do Acesso http://pt.wikipedia.org/wiki/Ficheiro:Washer.600pix 30/08/2012 .jpg M.Minderhoud/ GNU Free Documentation http://pt.wikipedia.org/wiki/Ficheiro:Koelkast_open 30/08/2012 License .jpg Christian Rasmussen/ Creative Commons - http://pt.wikipedia.org/wiki/Ficheiro:Microwave_ov 30/08/2012 Atribuição - Partilha nos Mesmos Termos en.jpg 3.0 Não Adaptada Valter Campanato/ABr / Creative Commons http://pt.wikipedia.org/wiki/Ficheiro:Condicionador 30/08/2012 Atribuição 3.0 Brasil dear.jpg Matias.Reccius/Domínio Público http://pt.wikipedia.org/wiki/Ficheiro:Minisystem.jp 30/08/2012 g CHG/Domínio público http://commons.wikimedia.org/wiki/File:Mirai_LCD 30/08/2012 _TV.JPG?uselang=pt-br Angeloleithold 2005/Disponibilizada por http://pt.wikipedia.org/wiki/Ficheiro:ItaipuAerea2A 30/08/2012 Massimiliano W/ Creative Commons AL.jpg Atribuição - Partilha nos Mesmos Termos 3.0 Não Adaptada Fernando Tomás de Zaragoza, Spain / http://pt.wikipedia.org/wiki/Ficheiro:Solar_Panels.j 30/08/2012 Disponibilizada por FlickrLickr/ Creative pg Commons - Atribuição 2.0 Genérica Tabela de Imagens n° do slide 4C direito da imagem como está ao lado da foto 5A Wagner Christian/ Creative Commons Atribuição - Partilha nos Mesmos Termos 2.5 Genérica Marcus Wong Wongm/ GNU Free Documentation License Cyberpunk/Creative Commons - CC0 1.0 Universal (CC0 1.0) Dedicação ao Domínio Público Aney/GNU Free Documentation License 5B Shaddack/Public Domain 5C Mbarousse/Public Domain 6 Autor desconhecido/Disponibilizada por Tomisti/Domínio Público Autor desconhecido/Disponibilizada por Kelson/Domínio Público Bcrowell/United States Public Domain 4D 4E 7 8A link do site onde se consegiu a informação Data do Acesso http://pt.wikipedia.org/wiki/Ficheiro:Windenergy.jp 30/08/2012 g http://pt.wikipedia.org/wiki/Ficheiro:Yallourn-w30/08/2012 power-station-australia.jpg http://pt.wikipedia.org/wiki/Ficheiro:Diferentes_Pil 30/08/2012 has_AA.JPG http://pt.wikipedia.org/wiki/Ficheiro:Alkali_battery _5.jpg http://pt.wikipedia.org/wiki/Ficheiro:PhotoCarBattery.jpg http://commons.wikimedia.org/wiki/File:Electr%C3 %B3lisis.png http://pt.wikipedia.org/wiki/Ficheiro:Thales.jpg 30/08/2012 30/08/2012 30/08/2012 30/08/2012 http://commons.wikimedia.org/wiki/File:Luigi_galva 30/08/2012 ni.jpg http://commons.wikimedia.org/wiki/File:Alessandro 30/08/2012 _volta2.jpg Tabela de Imagens n° do slide 8B 9 10 29 30 31 direito da imagem como está ao lado da foto link do site onde se consegiu a informação GuidoB/GNU Free Documentation License http://commons.wikimedia.org/wiki/File:VoltaBatte ry.JPG Lukas A, CZE / Public Domain http://commons.wikimedia.org/wiki/File:Rechargea ble_alkaline_battery.jpg Mbarousse/Public Domain http://commons.wikimedia.org/wiki/File:Electr%C3 %B3lisis.png Brianiac/Public Domain http://en.wikipedia.org/wiki/File:Batteries.jpg Victorgrigas/Creative Commons Attribution- http://en.wikipedia.org/wiki/File:India_Victor_Griga Share Alike 3.0 Unported s_2011-13.jpg Krdan/Public Domain http://pt.wikipedia.org/wiki/Ficheiro:Recycling_sym bol.svg Data do Acesso 30/08/2012 30/08/2012 30/08/2012 30/08/2012 30/08/2012 30/08/2012
Download