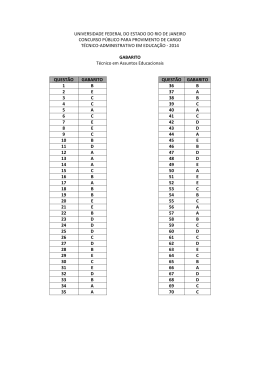
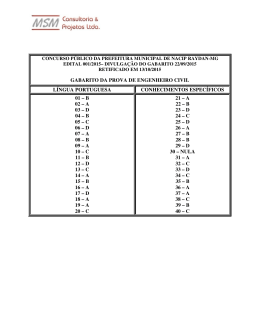
UNIVERSIDADE FEDERAL DO CEARÁ COORDENADORIA DE CONCURSOS – CCV Evento: Concurso Público para Provimento de Cargos Técnico-Administrativos em Educação Edital N° 101/2014 PARECER A Comissão Examinadora da Prova para o cargo de Tecnólogo em Química efetuou a análise do recurso administrativo e emitiu seu parecer nos termos a seguir. Questão 11 De acordo com a situação apresentada na questão, o teor de ácido acético na amostra de vinagre deverá ser realizado através de uma titulação ácido-base. Como no laboratório só dispõe de uma única base, solução de amônia (NH3) concentrada, portanto, essa titulação -5 ocorrerá através da reação entre o ácido acético (CH3COOH, um ácido fraco Ka = 1,8 x 10 ) presente no vinagre com a amônia (NH3, uma base fraca, Kb = 1,8 x 10 5 ) , de acordo com a seguinte equação química: CH3COOH(aq) + NH3(aq) àà CH3COONH4(aq) Ao final da titulação restará no meio apenas o acetato de amônio (CH3COONH4) em + solução e, o pH do meio será definido pelas espécies presentes, no caso CH3COO e NH4 . Ambos os íons sofrerão hidrólise de acordo com as seguintes equações químicas: CH3COO (aq) + H2O(l) (aq) + H2O(l) + CH3COOH(aq) + OH (aq) NH4 + NH3(aq) + H3O (aq) + Observa-se então pelos equilíbrios descritos acima, que a hidrólise do cátion (NH4 ) + + e do ânion (CH3COO ) gera tanto H3O e OH . Como Ka = Kb, [H3O ] = [OH ], portanto pH no ponto de equivalência será igual a 7,0. Desta forma o indicador mais apropriado pera acompanhar essa titulação, será aquele que apresenta ponto de viragem o mais próximo a 7,0 possível. Pelas alternativas apresentadas, observa-se que esse indicador é vermelho de cresol, faixa de viragem 7,2 – 8,8 e não a fenolftaleína, faixa de viragem 8,3 – 10,0, conforme alegado pelo impetrante. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 12 Em resposta ao recurso administrativo impetrado pelo candidato JOÃO CARLOS DE LIMA MONTEIRO a comissão emite o seguinte parecer: Realmente não haverá nenhuma reação química entre o tetracloreto e as espécies envolvidas no equilíbrio descrito na questão. O tetracloreto de carbono é um solvente apolar, imiscível em água. Desta forma, ao adicionar o tetracloreto de carbono no meio reacional haverá a formação de duas fases, uma aquosa e outra do tetracloreto. Das espécies envolvidas no equilíbrio apresentado na questão, apenas o iodo (I 2) é apolar, as demais são polares. Portanto, o iodo será mais solúvel no tetracloreto de carbono do que em água. Assim haverá a remoção de iodo da fase aquosa, ou seja, a concentração de iodo na fase aquosa diminuirá, deslocando o equilíbrio na fase aquosa para o lado dos reagentes. Portanto a alternativa B está correta, conforme divulgada no gabarito oficial. Diante do exposto a comissão indefere o recurso e ratifica o gabarito divulgado. Questão 13 Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 14 Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 15 Em face da argumentação apresentada, a Banca examinadora defere a solicitação e anula a questão. Questão 16 Em resposta ao recurso administrativo impetrado, a comissão esclarece que não há a necessidade de valores para as concentrações dos reagentes para que a questão seja resolvida. Conforme o enunciado da questão, 100mL de uma solução de um ácido fraco HA (1g do ácido) foi dividida em duas partes iguais. Ao chamar atenção que a solução original foi dividida, em partes iguais, assume-se que metade da quantidade de matéria do ácido fraco foi titulada e a outra metade permaneceu inalterada. Quando se mistura as duas temse, portanto, a mesma quantidade de matéria do ácido e da base conjugada(formada na titulação). Usando a equação de Henderson-Hasseelbach que diz: pH = pKa – log [base conjugada]/[ácido] se a quantidade de matéria da base conjugada é igual a quantidade de matéria do ácido que não reagiu então o segundo termo da equação torna-se nulo. Sendo assim, nesse caso especifico, ao medir o pH da solução após a mistura mede-se o valor do pka. [base conjugada] = [ácido] Então: log [base conjugada]/[ácido] logo: pH = pka Como o valor do pH apresentado é 4,0 então o valor do ka é igual a 1,0x10-4. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 17 Em resposta ao recurso administrativo impetrado a comissão mantém o gabarito oficial, pois, considerando os itens apresentados, é possível determinar a densidade de uma amostra sólida utilizando uma balança analítica (para pesagem de uma massa da amostra) e de uma proveta com água. Ao colocar a massa da amostra na proveta haveria deslocamento de volume, observado na escala da proveta, associado com a massa da amostra. Sabendo a massa e o volume da amostra é possível determinar a densidade de um material. E mais, a comissão considera que a “água” como solvente universal se faz presente em qualquer ambiente laboratorial, não havendo, portanto, necessidade de explicitá-la como um reagente incomum. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 20 Em resposta ao recurso administrativo impetrado a comissão mantém o gabarito oficial, pois: A) PCl3 assume geometria piramidal B) SiCl4 assume geometria tetraédrica C) Ligações Si-Cl são mais polares D) item correto E) Ligações no SiCl4 são predominantemente covalentes Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 21 Em resposta ao recurso administrativo impetrado, a comissão julga improcedente os pedidos e esclarece. As alternativas são: A) SnCl2 e AgNO3 ocorre redução da prata espontaneamente. B) ZnCl2 e NiCl2 ocorre redução do níquel espontaneamente. C) KBr e AgNO3 ocorre redução da prata espontaneamente. D) Br2 e KBr ocorre redução do potássio espontaneamente. E) Br2 e NiCl2 ocorre redução do níquel espontaneamente. Para que um processo redox seja espontâneo, o potencial da cela deve ser maior do que zero. Na alternativa A para a prata ser reduzida pode ocorrer a oxidação de duas espécies, Sn2+ e Cl2. A cela com o Cl2 se oxidando tem potencial de -0,56V, portanto não espontâneo. Já com o Sn2+ se oxidando o potencial da cela é +0,65V, portanto espontâneo. O mesmo segue na alternativa B, redução do níquel e oxidação do Cl2, potencial -1,61V. Na alternativa C existe duas possibilidades de oxidação, brometo (potencial da cela -0,28V) ou do nitrato (potencial da cela -0,16V). Alternativa B tem potencial da cela -4,005V). Alternativa D tem potencial de cela -4,005V. A alternativa E tem potencial de cela -1,33V. Portanto apenas a alternativa A está correta conforme divulgado no gabarito oficial. A mistura das soluções de SnCl2 e AgNO3 produz um precipitado de AgCl. Mesmo essa espécie tendo baixo produto de solubilidade, haverá íons Ag+ em solução que serão reduzidos pelo Sn2+. É fato que a concentração desse íon será muito baixa, mas mesmo assim eles existirão em solução, não inviabilizando a questão conforme alegado por um candidato. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 30 Em resposta ao recurso administrativo impetrado, a comissão resolve não acatar a solicitação do candidato pois expressar a concentração de um soluto considerando a quantidade de matéria (mol) em uma massa de solvente (kg), é largamente empregada no estudo de propriedades coligativas. Ainda sobre a mesma questão, quando o enunciado diz que uma massa de 282g de C12H22O11 está dissolvida em um litro de solução é necessário considerar que esse volume não é proveniente somente de água. Para encontrar a massa de água faz-se uso da informação da densidade conforme ilustrado a seguir: 1mL de solução ------------- 1,127g de solução (água + C12H22O11) Em um litro de solução tem-se 282 de C 12H22O11 então em 1mL de solução (10-3L) tem-se 0,282g de C12H22O11. Se a densidade diz que 1,127g de solução está em 1mL e que nesse volume a massa de C12H22O11 é igual a 0,282g então a massa de água será: 1,127g – 0,282g = 0,845g de água. Com essas informações é possível encontrar a molalidade da solução: Molalidade = número de mol C12H22O11 / massa água (Kg) = (0,282/342) / 0,845x10-3 = 0,97mol kg-1 Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 31 Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 35 Em resposta ao recurso administrativo impetrado, a comissão esclarece que não há equívoco na divulgação do gabarito. Se um ácido monoprótico de concentração 0,1 mol L-1 encontra-se 1% dissociado significa dizer que ao atingir o equilíbrio de dissociação tem-se: HA início 0,1 + H2O H3O+ - + A- equilíbrio Em face 0,099 0,001 0,001 da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 39 Em resposta ao recurso administrativo impetrado, a comissão considera improcedente o pedido conforme relato abaixo. Na questão não há necessidade de se conhecer os valores exatos dos raios das espécies Al3+, Ca2+ e K+ para se fazer uma correlação dos valores de seus raios. Apenas com a posição dos elementos Al, Ca e K na tabela periódica é possível se estimar os raios dos cátions. Como a tabela periódica foi fornecida a questão pode ser respondida sem problemas. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 40 Em resposta ao recurso administrativo impetrado, a comissão considera improcedente o pedido conforme relato abaixo. Os livros de Química não citam o nome do cientista Antonie Lavoisier no desenvolvimento da Tabela Periódica. Desta forma a única alternativa correta seria a letra A. Adicionalmente, no recurso do candidato é citado um site na Internert para sua defesa. No próprio site (wikipedia.org/wiki/História_da_tabela_periódica – acessado em 25/06) pode se observar que ele exclui Lavoisier do desenvolvimento da história da tabela periódica: “A história da tabela periódica começa em 1817 com a "lei das tríades" de Johann Wolfgang Döbereiner e termina com a disposição sistemática de Dmitri Mendeleev e Lothar Meyer dos elementos químicos demonstrando a periodicidade dos mesmos em uma tabela organizada. Na mesma página pode se observar que as observações de Lavoisier foram realizadas bem antes desta data: “O livro Traité Élémentaire de Chimie (1789) de Antoine Lavoisier foi o marco seguinte na história da tabela periódica ao publicar uma lista com 33 substâncias elementares, isto é que não podiam ser decompostas em reações químicas, e das quais muitas fazem parte da tabela atual. Lavoisier classificou tais elementos em quatro grupos: substâncias simples, metálicas, não-metálicas e salificáveis ou terrosas.” Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 41 Em resposta ao recurso administrativo impetrado, a comissão esclarece que a observação do efeito fotoelétrico faz parte da história do desenvolvimento da estrutura atômica. Portanto, constitui-se um item relacionado com a História da Química e que é contemplado no edital. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 42 Considerando falha existente na construção da questão, a Comissão defere a solicitação e anula a questão. Questão 43 Em resposta ao recurso administrativo impetrado, a comissão esclarece que: O potencial-padrão é uma propriedade intensiva. Desta forma, a variação do coeficiente estequiométrico em uma semi-reação não afeta o valor do potencial-padrão. Isto é: Ag+ (aq) + e- → Ag (s) + 2 Ag (aq) + 2 e- → 2 Ag (s) E°red = + 0,80 V E°red = + 0,80 V Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 44 Em resposta ao recurso administrativo impetrado, a comissão defere os recursos e altera o gabarito para a letra B. Questão 45 Em resposta ao recurso administrativo impetrado, a comissão julga improcedente os argumentos apresentados e esclarece que: o item A diz pobres condutores de eletricidade enquanto o item B diz bons condutores de eletricidade. Isso faz com que os itens A e B não sejam iguais. O item C não pode ser igual pois diferencia do item A quanto à condução eletricidade e do item B quanto a ser maleável. Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Questão 46 Em resposta ao recurso administrativo impetrado, a comissão julga procedente os argumentos apresentados pelos candidatos, defere o recurso e anula a questão. Questão 49 Em resposta ao recurso administrativo impetrado, a comissão julga improcedente os argumentos apresentados pelos candidatos e esclarece. Para resolver a questão foi informado que o reagente em excesso é AB2. A partir dessa informação e assumindo um rendimento de 100 % na reação pode se encontrar que a massa de CD usada na reação foi 4,0 g. Desta forma, na mistura inicial de AB 2 e CD, temos 10,0 g, sendo 4,0 g de CD (40%) e 6,0 g de AB 2 (60%). A única alternativa correta seria a letra D Em face da argumentação apresentada, a Banca examinadora indefere a solicitação e ratifica o gabarito anteriormente divulgado. Fortaleza, 16 de junho de 2014. Profa. Maria de Jesus de Sá Correia Presidente da Coordenadoria de Concursos – CCV
Download