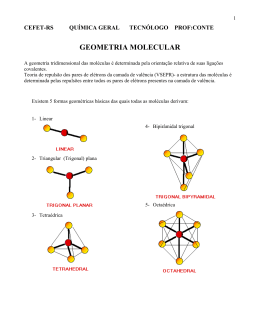
Prof. Iremar GEOMETRIA MOLECULAR Geometria molecular é o estudo de como os átomos estão distribuídos espacialmente em uma molécula. Esta pode assumir várias formas geométricas, dependendo dos átomos que a compõem. As principais classificações são linear, angular, trigonal plana, piramidal e tetraédrica. Para se determinar a geometria de uma molécula, é preciso conhecer a teoria da repulsão dos pares eletrônicos da camada de valência. TEORIA DA REPULSÃO DOS PARES ELETRÔNICOS Baseia-se na ideia de que pares eletrônicos da camada de valência de um átomo central, estejam fazendo Ligação química ou não, se comportam como nuvens eletrônicas que se repelem, ficando com a maior distância angular possível uns dos outros. Uma nuvem eletrônica pode ser representada por uma ligação simples, dupla, tripla ou mesmo por um par de elétrons que não estão a fazer ligação química. Essa teoria funciona bem para moléculas do tipo ABx, em que A é o átomo central e B é chamado elemento ligante. De acordo com essa teoria, os pares de elétrons da camada de valência do átomo central (A) se repelem, produzindo o formato da molécula. TIPOS DE GEOMETRIA MOLECULAR Existe a geometria angular; geometria piramidal trigonal; e a geometria tetraédrica, depois existem a geometria linear que é composta pela ligação covalente simples, ligação covalente dupla e ligação covalente tripla. Linear: Acontece em toda molécula biatômica (que possui dois átomos) ou em toda molécula em que o átomo central possui no máximo duas nuvens eletrónicas em sua camada de valência. Exemplo: Ácido clorídrico (HCl) e gás carbônico (CO2). Trigonal plana ou triangular: Acontece somente quando o átomo central tem três nuvens eletrónicas em sua camada de valência. Estas devem fazer ligações químicas, formando um ângulo de 120 graus entre os átomos ligados ao átomo central. Angular: Acontece quando o átomo central tem três ou quatro nuvens eletrônicas em sua camada de valência. No caso de três, duas devem estar fazendo ligações químicas e uma não, formando um ângulo de 120 graus entre os átomos ligantes. Quando há quatro nuvens, duas devem fazer ligações químicas e duas não, formando um ângulo de 104° 34' (104,45°) entre os átomos. Tetraédrica: Acontece quando há quatro nuvens eletrónicas na camada de valência do átomo central e todas fazem ligações químicas. O átomo central assume o centro de um tetraedro regular. Ângulo de 109º 28' Piramidal: Acontece quando há quatro nuvens eletrônicas na camada de valência do átomo central, sendo que três fazem ligações químicas e uma não. Os três átomos ligados ao átomo central não ficam no mesmo plano. O ângulo é de 107°. Bipiramidal: Acontece quando há cinco nuvens eletrónicas na camada de valência do átomo central, todas fazendo ligação química. O átomo central assume o centro de uma bipiramide trigonal. Octaédrica: Acontece quando há seis nuvens eletrónicas na camada de valência do átomo central e todas fazem ligações químicas formando ângulos de 90 graus e 180 graus. TABELA DE GEOMETRIA MOLECULAR / Domínios eletrônicos D.E. ligantes D.E. não ligantes 2 2 0 linear 180° CO2 3 3 0 trigonal plana 120° BF3 3 2 1 angular 120° (119°) SO2 4 4 0 tetraédrica 109.5° CH4 4 3 1 piramidal 109.5° (107.5°) NH3 4 2 2 angular 109.5° (104.5°) H2O 5 5 0 bipiramidal trigonal 90°, 120° PCl5 Geometria Ângulo das Exemplo Imagem ligações 180°, 120° (173.1°, 101.6°) 90°, 180° (87.5°, < 180°) 5 4 1 gangorra SF4 5 3 2 forma de T 5 2 3 linear 180° XeF2 6 6 0 octaédrica 90° SF6 6 5 1 piramidal quadrada 90° (84.8°) BrF5 6 4 2 quadrada plana 90° XeF4 7 7 0 bipiramidal pentagonal 90°, 72° IF7 ClF3
Download