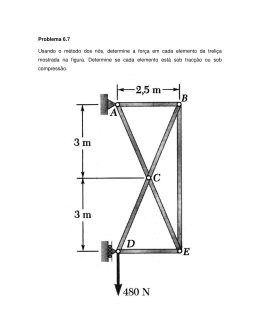
ESCOLA SECUNDÁRIA LEAL DA CÂMARA FICHA DE TRABALHO QUÍMICA Unidade 3: Fórmulas Empíricas e Moleculares 12.º ANO 1. 0 glutamato de sódio é suspeito de ser o responsável pelo "síndroma do restaurante chinês", uma vez que este intensificador de sabor pode produzir dores de cabeça e no peito. A sua composição mássica é: C: 35,50%; H: 4,77%; O: 37,85%; N: 8,28%; Na: 13,60%. 1.1. Determine a sua fórmula empírica. (R: C5 H8 O4 NNa) 1.2. 0,5 mol deste composto produzem 44,80 dm3 (PTN) de vapor de água. Determine a sua fórmula molecular. (R: C5 H8 O4 NNa) 2. Uma amostra de 0,72 g de um composto orgânico, originou por combustão completa 1,76 g de CO2 e 0,72g de H2 O. 2.1. Determine a sua fórmula empírica. (R: C4 H8 O) 2.2. Determine a sua fórmula molecular atendendo a que 0,2 mol do composto origina, por combustão completa, 17,92 dm3 de CO2 (PTN). 3. Uma amostra de colesterol tem a seguinte composição: 27,86 g de C; 2,382x10 24 átomos de H; 0,086 mol de O A combustão completa de 1/3 mol de colesterol origina 9,0 mol de CO2 . Indique: 3.1. A fórmula empírica do colesterol. (R: C27 H46 0) 3.2. A fórmula molecular. (R: C27 H46 0) 4. A análise elementar de um composto orgânico revelou ser constituída pelos elementos: carbono, hidrogénio, azoto e oxigénio. Uma amostra de 1,279 g foi completamente queimada, dando origem a 1,60 g de dióxido de carbono e 0,77 g de água. Uma segunda amostra de 1,625 g continha 0,216 g de azoto. Determine a sua fórmula empírica. (R: C3 H7 O3 N) 5. A análise elementar de um hidrocarboneto gasoso mostrou que a percentagem em massa de carbono era 85,7%. Quando uma amostra de 1,77 g desse gás era armazenado num recipiente de 1,5 L de capacidade, a 17ºC, a pressão era de 508 Torr. Qual a fórmula molecular do hidrocarboneto? (R:C3 H6 ) 6. Na preparação de corantes utilizam-se alguns compostos orgânicos. Uma amostra de um composto orgânico, de massa igual a 3,74 g contendo 15,0% de azoto produz por combustão completa 5,376 dm3 de dióxido de carbono (PTN) e 0,140 mol de vapor de água. 6.1. Determine a fórmula empírica do composto.(R: C6 H7 N) 6.2. Dissolvendo 1,822mL do composto em 200mL de água obtém-se uma solução 0,10 mol/kg. Tendo as densidades do composto e da água respectivamente os valores de 1,022 e 1,00; determine a fórmula molecular do composto analisado. (R: C6 H7 N) 6.3. Sabendo que o composto referido pertence ao grupo das aminas estabeleça a sua fórmula de estrutura plana. 1
Download