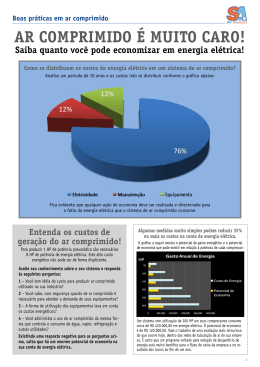
DISCIPLINA: CIÊNCIAS DATA: PROFESSORES: WELLINGTON LIMA /VALÉRIA ETAPA: 3ª ASSUNTO: TRABALHO DE RECUPERAÇÃO QUÍMICA VALOR: 20 pontos NOTA: SÉRIE: 3ª EM TURMA: A/B/Anchieta NOME COMPLETO: Nº: CONTEÚDO Funções orgânicas Termoquímica Cinética química Propriedades periódicas Equilíbrio químico Soluções Reações redox Pilhas ORIENTAÇÕES O trabalho deve ser entregue na data estabelecida conforme o calendário de recuperação final. As respostas devem vir seguidas das respectivas perguntas. (pode recortar a pergunta e colar) O trabalho deve ser manuscrito, com letra legível e caprichada. As folhas devem ser pautadas e com margem. A capa deve conter o nome do Colégio, professor, turma, nome e número do aluno. Em caso de dúvidas, procure a orientação do professor. 1-Quando animais são submetidos ao estresse por aumento da temperatura ambiente, reduz-se não somente a produção de leite, mas também alguns de seus componentes como, por exemplo, a lactose, que pode ser medida pelo conteúdo das moléculas, cuja estrutura é mostrada abaixo. OH H3C C H COOH INDIQUE os grupos funcionais presentes na molécula acima. 2- CONSTRUA as fórmulas estruturais dos ácidos: I. metanóico, II. etanóico, III. metil-propanóico IV. 2-metil-butanóico. 3- A respeito da nomenclatura e fórmula molecular dos compostos, NUMERE a segunda coluna de acordo com a primeira: 1. Metanol ( ) HCHO 2. Etanol ( ) CH3CHO 3. Propan-1-ol ( ) C3H7OH 4. Etanal ( ) CH3COOH 5. Ácido Etanóico ( ) CH3OH 6. Metanal 4 - Nossos corpos podem sintetizar onze aminoácidos em quantidades suficientes para nossas necessidades. Não podemos, porém, produzir as proteínas para a vida a não ser ingerindo os outros nove, conhecidos como aminoácidos essenciais. INDIQUE apenas funções orgânicas encontradas no aminoácido essencial fenilalanina, mostrada na figura acima. 5 - A partir dos valores de ∆H DETERMINE a variação de entalpia do processo: N2 (g) + O2 (g) → 2 NO2 (g) ∆H = ? I) N2 (g) + 2O2 (g) → 2 NO (g) II) 2 NO2 (g) + O2 (g) → 2 NO (g) ∆H = + 66 kJ.mol-1 ∆H = –113 kJ.mol-1 6 – DETERMINE a variação de entalpia da seguinte reação: N 2 H 4(l ) H 2( g ) 2 NH 3( g ) A partir das estapas: ∆H = + 51 kJ/mol N 2( g ) 2H 2( g ) N 2 H 4(l ) N 2( g ) 3H 2( g ) 2 NH 3( g ) ∆H = - 92 kJ/mol 7 – CALCULE o ∆H da reação abaixo: P4 (s) + 10 Cl2 (g) → 4 PCl 5 (s) etapas: I) P4 (s) + 6 Cl2 (g) → 4 PCl 3 (l) II) 4 PCl 3 (l) + 4 Cl2 (g) → 4 PCl 5 (s) ∆H = ? ∆H = –1.279 kJ.mol-1 ∆H = – 496 kJ.mol-1 8- (UFT TO) O gráfico a seguir representa uma reação hipotética X Y. Com a análise do gráfico é CORRETO afirmar: a) A reação hipotética X Y, representa um processo endotérmico. b) A seta C representa a energia de ativação do composto X em uma reação em presença de catalisador. c) As curvas A e B representam o ganho de energia da reação. d) Apenas a curva B representa um processo exotérmico. e) As setas C e D representam a energia liberada pela reação. 9 - Considere a equação para a reação de obtenção do dióxido de nitrogênio: 2NO(g) + O2(g) 2NO2(g) Com base na equação acima, responda: a) QUAL a expressão de velocidade para a equação acima? b) Se triplicarmos a concentração do NO e O2 a velocidade da reação aumenta em QUANTAS vezes? c) QUAL a ordem global da reação? 10 - (MACK SP) Um aluno, querendo verificar os conceitos de cinética-química discutidos na escola, dirigiu-se a uma drogaria e comprou alguns comprimidos efervescentes, os quais continham, de acordo com o rótulo do produto, massas iguais de bicarbonato de sódio. Ao chegar a sua casa realizou a mistura desses comprimidos com água usando diferentes métodos. Após a observação do fenômeno de liberação gasosa, até que toda a massa de cada comprimido tivesse sido dissolvida em água, o aluno elaborou a seguinte tabela: Estadodo Temperatura Tempo Método Comprimido da água de reação 1 Inteiro 10ºC 50 s 2 Triturado 60ºC 15 s 3 Inteiro 60ºC 25 s 4 Triturado 10ºC 30 s De acordo com os resultados obtidos e mostrados na tabela acima, o aluno fez as seguintes afirmações: ( ) Ao comparar somente os métodos 1 e 2 fica impossível determinar qual dos dois fatores variados (estado do comprimido e temperatura da água), aumentou mais a velocidade da reação. ( ) A mudança da condição da água, de fria para quente, faz com que, qualquer que seja o estado do comprimido, a velocidade da reação caia pela metade. ( ) A influência da temperatura da água é maior do que a influência do estado do comprimido, no aumento da velocidade da reação. CLASSIFIQUE-AS como verdadeiras ou falsas, neste último caso corrija-as. 11 - (UEMG) Um professor, utilizando comprimidos de antiácido efervescente à base de NaHCO3, realizou quatro procedimentos, ilustrados a seguir: Procedimento I – Comprimido inteiro e água a 25 ºC Procedimento II – Comprimido inteiro e água a 5 ºC Procedimento III – Comprimido pulverizado e água a 25 ºC Procedimento IV – Comprimido pulverizado e água a 5 ºC A reação ocorreu mais rapidamente no procedimento a) I. b) II. c) III. d) IV. e) II e III 12- (MACK SP/Janeiro) Na tabela periódica abaixo, alguns elementos químicos foram representados aleatoriamente por algarismos romanos. A respeito de tais elementos é CORRETO afirmar que a) VI é o elemento mais eletronegativo. b) I, II e IV são líquidos à temperatura ambiente. c) III e VII são denominados elementos representativos. d) 3s2 3p2 é a configuração eletrônica da camada de valência de V. e) VIII pertence a família dos calcogênios. 13 - (UFG GO) A reação química descreve a transformação do composto A em um complexo ativado intermediário que, por sua vez, forma o composto B. A Complexo Ativado B + calor O gráfico a seguir apresenta a relação entre a energia e o caminho da reação. Considerando o exposto, a) CALCULE a energia de ativação e a variação de entalpia (H) da reação. b) ESBOCE um gráfico entre a energia e o caminho da reação inversa. 14 - INDIQUE os agentes redutores e oxidantes das reações descritas abaixo: a)Cd+2Ni(OH)3 CdO+2Ni(OH)2+H2O b) Pb(s) + PbO2 + 4H++2SO42- 2PbSO4 + 2H2O c) Ni + Cu2+ Ni2+ + Cu 15 - (UFT TO) O gráfico a seguir representa uma reação hipotética X Y. Com a análise do gráfico é CORRETO afirmar: a) A reação hipotética X Y, representa um processo endotérmico. b) A seta C representa a energia de ativação do composto X em uma reação em presença de catalisador. c) As curvas A e B representam o ganho de energia da reação. d) Apenas a curva B representa um processo exotérmico. e) As setas C e D representam a energia liberada pela reação. 16 - OBSERVE o gráfico a seguir e RESPONDA às questões que se seguem . a) QUAL a menor quantidade de água necessária para dissolver completamente, a 60°C, 120g de B? b) QUAL a massa de A necessária para preparar, a 0°C, com 100g de água, uma solução saturada (I) e outra solução insaturada (II)? 17 - (UFMG-2002) Ao se sair molhado em local aberto, mesmo em dias quentes, sente-se uma sensação de frio. Esse fenômeno está relacionado com a evaporação da água que, no caso, está em contato com o corpo humano. EXPLIQUE em termos termoquímicas esta sensação de frio. 18 - Dadas às equações termoquímicas: H2 (g) + 1 / 2 O2(g) H2O (l)∆H = – 68,3 kcal/mol. CaO (s) + H2O (l) Ca(OH)2 (s)∆H = – 15,3 kcal/mol Ca(s) + 1 / 2 O2 (g) CaO (s) ∆H = – 151,8 kcal/mol CALCULE 0 calor de formação do Ca(OH)2 (s) Ca + H2 + O2 Ca(OH)2 19 - Considere a célula eletroquímica a seguir e os potenciais das semi-reações: Sobre o funcionamento da pilha, e fazendo uso dos potenciais dados, DETERMINE a ddp e o sentido do fluxo dos elétrons. 20 - Analise a tabela a seguir e ASSINALE a alternativa que contém uma reação redox espontânea nas condições-padrão (298 K). a) Pb2+ + 2Ag Pb + 2Ag+ b) Ni2+ + Cu Ni + Cu2+ c) Zn2+ + Ni Zn + Ni2+ d) 2Ag+ + Cu 2Ag + Cu2+ e) Cu + 2H+ Cu2+ + H2
Download