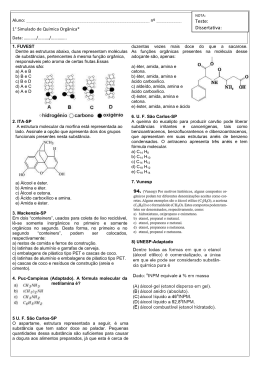
LISTA DE RECUPERAÇÃO - 3º INTEGRADO QUÍMICA Objetivas e Discursivas: 01 - “Era uma triste imagem: um carro velho queimando gasolina (1) e poluindo o ambiente. A lataria toda amassada (2) e enferrujada (3). A água do radiador fervendo (4). Para tristeza de João, o dono do carro, estava na hora de aposentar aquela lata-velha a que ele tanto tinha afeição.” Observa-se neste pequeno texto que (1), (2), (3) e (4), são respectivamente fenômenos: a) químico, físico, físico e físico. b) químico, físico, químico e físico. c) físico, químico, químico e físico. d) físico, químico, físico e químico. e) físico, químico, químico e químico. a) Niels Bohr. b) John Dalton. c) J.J. Thomson. d) Ernest Rutherford e) Demócrito 08 - O ácido metanóico (fórmico), encontrado em algumas formigas é causador da irritação provocada pela picada desses insetos, tem a se guinte fórmula: HCOOH. O átomo de carbono dessa molécula apresenta hibridação: a) sp com duas ligações sigma (σ) e duas ligações pi (π). b) sp2 com três ligações sigma (σ) e uma ligação pi (π). c) sp2 com uma ligação sigma (σ) e três ligações pi (π). d) sp3 com três ligações sigma (σ) e uma ligação pi (π). 09 - Determine o número de carbonos primários, secundários, terciários e quaternários existentes em cada uma das estruturas a seguir e escreva suas fórmulas moleculares: 02 - Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm³. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de: a) 2.600 g b) 3.200 g c) 4.800 g d) 6.500 g e) 7.400 g 03 - O rótulo de uma garrafa de água mineral apresenta a seguinte informação. Composição Química Provável: sulfato de cálcio = 0,0038 mg/L, bicarbonato de cálcio = 0,0167 mg/L. Com base nessas informações, podemos classificar a água mineral como: a) substância pura. b) substância simples. c) mistura heterogênea. d) mistura homogênea. e)suspensão coloidal 04 - O processo inadequado para separar uma mistura heterogênea sólido-líquido é : a) filtração. b) decantação. c) centrifugação. d) destilação. e) sifonação 05 - O íon do átomo de um determinado elemento é bivalente positivo e tem 18 elétrons. A que família e período da classificação periódica, pertence esse elemento? a) 3º período, gás nobre b) 3º período, halogênio c) 4º período, metais alcalinos d) 4º período, metais alcalino-terrosos e) 3º período, calcogênios 10 - Radicais são estruturas que apresentam pelo menos um elétron livre (R–). Através desse elétron livre (valência), os radicais podem se unir, originando um novo composto. Veja um exemplo: 06 - Um elemento A, com número de massa 27 e 14 nêutrons, combina-se com um elemento B que apresenta número de massa 32 e 16 nêutrons. O tipo de ligação e a fórmula resultante desta combinação serão, respectivamente: a) covalente, AB. b) iônica, A2B3. c) covalente, A2B. d) iônica, A3B2. e) covalente, A2B3 Com base nesse exemplo, faça a união dos radicais a seguir e dê o nome dos compostos obtidos: 07 - Em fogos de artifício, observam-se as colorações, quando se adicionam sais de diferentes metais às misturas explosivas. As cores produzidas resultam de transições eletrônicas. Ao mudar de camada, em torno do núcleo atômico, os elétrons emitem energia nos comprimentos de ondas que caracterizam as diversas cores. Esse fenômeno pode ser explicado pelo modelo atômico proposto por 11 - A gripe suína, influenza A (H1N1), tem sido assunto de destaque nos noticiários de TV, em 2009. O fosfato de oseltamivir, comercializado com o nome de Tamiflu®, é o medicamento recomendado pela OMS (Organização Mundial da Saúde) para combater a gripe suína. A estrutura química do oseltamivir é apresentada na figura. RECUPERAÇÃO FINAL 2015 a) etil + sec-butil; b) isopropil + isobutil; 1 LISTA DE RECUPERAÇÃO - 3º INTEGRADO A) Etanoato de metila B) Cloreto de isobutila C) Cloreto de propanoíla D) 1-Butino E) 4-Cloro-3-metil-2-penteno F) Etanamida O ( ( ( ( ( ( ) ) ) ) ) ) O O C HN O H2N Na estrutura química do oseltamivir, são encontrados os grupos funcionais orgânicos que contêm oxigênio: a) ácido carboxílico, aldeído e éter. b) ácido carboxílico, éter e amina. c) amida, aldeído e éster. d) amida, éter e éster. e) amina, éter e éster. 12 - Muitas funções orgânicas são responsáveis pelo sabor e aroma dos produtos que utilizamos em nosso dia a dia. No quadro abaixo, podemos observar alguns compostos orgânicos com sua fórmula estrutural e aroma característico. Cite o grupo funcional presente nos compostos 1, 2, 3, 4, e 5, respectivamente. 14 - Identifique se os compostos são isômeros e o tipo de isomeria existente entre eles: a) etanol e metóxi-metano b) propan-1-ol e propan-2-ol c) metilpropilamina e dietilamina d) ácido propanóico e etanoato de etila e) pentan-2-ol e pentan-3-ona 15 - Escreva o nome de um composto orgânico que satisfaça a todos os requisitos abaixo: a) possuir a fórmula molecular C5H8O; b) pertencer a função aldeído; c) possuir um átomo de carbono assimétrico em sua molécula 16 - Considere o esquema abaixo, que representa reações químicas de desidratação. Represente a fórmula estrutural dos produtos X e Y. 17 - No sistema de equações a seguir, identifique o nome e a formula estrutural as substâncias A e B 18 - No diagrama abaixo estão representados os caminhos de uma reação na presença e na ausência de um catalisador. a) éter, aldeído, amina, álcool, éster. b) éster, aldeído, amina, álcool, éster. c) éter, cetona, amida, fenol, ácido carboxílico. d) éster, cetona, amina, álcool, éster. e) éter, aldeído, amida, fenol, éter. 13 - Dada as fórmulas abaixo, faça as associações corretas. 1) 4) 2) CH3COOCH3 5) Cl Cl O 3) CH3CONH2 6) CH3- CH2- C Com base neste diagrama, é correto afirmar que: 01) A curva II refere-se à reação catalisada e a curva I refere-se à reação não catalisada 02) Se a reação se processar pelo caminho II, ela será mais rápida 04) A adição de um catalisador à reação diminui valor de ∆H 08) O complexo ativado da curva I apresenta a mesma energia do complexo ativado da curva II 16) A adição do catalisador transforma a reação endotérmica em exotérmica Soma: ( ) 19 - A combustão completa do etanol ocorre pela equação Cl RECUPERAÇÃO FINAL 2015 C2H5OH + 3O2 2CO2 + 3H2 O 2 LISTA DE RECUPERAÇÃO - 3º INTEGRADO Considerando que 1h de reação foram produzidos 2640g de gás carbônico, calcule a velocidade da reação, expressa em números de mols de etanol consumido por minuto. 20 - Na eletrólise, em solução aquosa, de CuSO4, quais as substâncias que se depositam ou se desprendem nos eletrodos? 21 - Balancear uma equação química é determinar os valores dos seus coeficientes de modo a satisfazer certas condições. Considere a equação química não balanceada: a) o agente redutor sofre redução b) a substância que perde elétrons é o agente redutor c) o nox do agente oxidante aumenta d) o nox do agente redutor diminui e) a substância que ganha elétrons é o agente redutor 28 – Quando o ferro metálico (Fe) reage com a vapor de águas em altas temperaturas, há liberação de gás hidrogênio e formação de óxido de ferro III (Fe2O3). A equação, não balanceada, da reação descrita é: Fe(s) + H2O(vapor) Com base no exposto, é correto afirmar que a equação acima, quando balanceada, deve satisfazer as condições: ( ) A soma das massas dos produtos deve ser igual à soma das massas dos reagentes. ( ) O número de átomos de um elemento químico deve ser conservado durante a reação química. ( ) O número total de íons entre os produtos deve ser igual ao número total de íons entre os reagentes. ( ) A soma dos coeficientes dos produtos deve ser igual à soma dos coeficientes dos reagentes. ( ) A soma das cargas elétricas dos produtos deve ser igual à soma das cargas elétricas dos reagentes. ( ) O total de elétrons cedidos pelo agente redutor deve ser igual ao total de elétrons recebidos pelo agente oxidante. 22 - Óxido nítrico reage com hidrogênio, produzindo nitrogênio e vapor de água, de acordo com a seguinte equação: 2NO ( g) + 2H 2( g) → N 2( g) + 2H 2 O ( g) Acredita-se que essa reação ocorra em duas etapas: 2NO + H 2 → N 2 O + H 2 O (lenta) N 2 O + H 2 → N 2 + H 2 O (rápida) De acordo com esse mecanismo, escreva a expressão de velocidade da reação e determine a ordem da reação. 23 - Na química ambiental, que procura, entre outras coisas, avaliar formas de atenuar a emissão de substancias gasosas que depreciam a qualidade do ar, a reação entre os gases monóxido de carbono e oxigênio, para produzir o dióxido de carbono tem grande importância. A equação representativa dessa X H2 + Fe2O3(s) O agente oxidante e o menor coeficiente estequiométrico, inteiro, representado na equação pela letra X são, respectivamente, a) H2O e 3 c) H2O e 2 e) Fe2O3 e 1 b) Fe2O3 e 2 d) Fe e 3 29 – O ferro galvanizado apresenta-se revestido por uma camada de zinco (Zn). Se um objeto desse material for riscado, o ferro ficara exposto às condições do meio ambiente e poderá formar o hidróxido ferroso (Fe(OH)2. Neste caso, o zinco, por ser mais reativo, regenera o ferro, conforme a equação representada abaixo: Fe(OH)2 + Zn Zn(OH)2 + Fe Sobre essa reação pode-se afirmar que: a) O ferro sofre oxidação, pois perderá elétrons. b) O zinco sofre oxidação, pois perderá elétrons. c) O ferro sofre redução, pois perderá elétrons. d) O zinco sofre redução, pois ganhará elétrons. e) O ferro sofre oxidação, pois ganhará elétrons 30 - Considerando as seguintes substâncias e íons: I – HNO3 II – NH3 III – N2 + IV – NH4 V – Ca(NO3)2. Quais apresentam nitrogênio com nox igual a –3? a ) I, II e IV c) somente II e IV e) I, III e V b) somente III e V d) todas v1 reação é: 2CO ( g) + O 2( g) ↔ 2CO2(g). Quando se duplicarem, v2 simultaneamente, as concentrações de CO e O2, efetuando a reação em sistema fechado, por quantas vezes ficará multiplicada a velocidade da reação v1? 24 - Em relação à molécula de H2O , indique: a) O nome do tipo de ligação existente entre seus átomos: b) A estrutura eletrônica e a estrutura plana do composto (respeitando a sua geometria): c) A polaridade do composto: 25 - Na limpeza de uma casa, acidentalmente, caiu um pouco de ácido muriático sobre o piso de mármore. O dono da casa agiu rapidamente. Absorveu o ácido com um pano e, a seguir, espalhou sobre o local atingido, um dos seguintes "produtos" comumente encontrados numa residência: vinagre, água, amoníaco ou sal de cozinha. Dentre essas opções, o dono escolheu a melhor. Qual foi essa opção? Justifique sua resposta. 26 - Por que o H2S evapora mais facilmente que a H2O, segundo o que aprendeu sobre ligações químicas? 27 - Para uma reação de oxi-redução: RECUPERAÇÃO FINAL 2015 3
Download