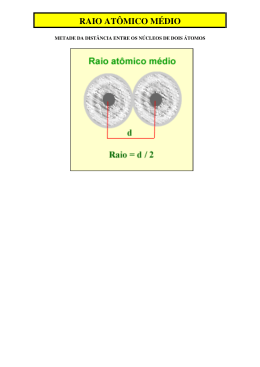
CURSINHO ETWB 2012 Componente Curricular: Química Professor: Ricardo Honda Data: Terça-feira, 14/02/2012 Tema da aula: Propriedades periódicas “As propriedades periódicas são aquelas que, à medida que o número atômico aumenta, assumem valores crescentes ou decrescentes em cada período, ou seja, repetem-se periodicamente. Exemplo: o número de elétrons na camada de valência”. Raio atômico: o tamanho do átomo O tamanho do átomo é uma característica difícil de ser determinada, pois a eletrosfera de um átomo não tem fronteira definida. De maneira geral, para comparar o tamanho dos átomos, devemos levar em conta dois fatores: Número de níveis (camadas): quanto maior o número de níveis, maior será o tamanho do átomo. Caso os átomos comparados apresentem o mesmo número de níveis (camadas), devemos usar outro critério. Número de prótons: o átomo que apresenta maior número de prótons exerce uma maior atração sobre seus elétrons, o que ocasiona uma redução no seu tamanho. Generalizando: • numa mesma família: o raio atômico (tamanho do átomo) aumenta de cima para baixo na tabela, devido ao aumento do número de níveis; • num mesmo período: o tamanho do átomo aumenta da direita para a esquerda na tabela, devido à diminuição do número de prótons nesse sentido, o que diminui a força de atração sobre os elétrons. Energia de ionização É a energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso. 0 + – X (g) + energia → X (g) + e Quanto maior o raio atômico, menor será a atração exercida pelo núcleo sobre o elétron mais afastado; portanto, menor será a energia necessária para remover esse elétron. Generalizando: Quanto maior o tamanho do átomo, menor será a primeira energia de ionização. • numa mesma família: a energia de ionização aumenta de baixo para cima; • num mesmo período: a E.I. aumenta da esquerda para a direita. Ao retirarmos o primeiro elétron de um átomo, ocorre uma diminuição do raio. Por esse motivo, a energia necessária para retirar o segundo elétron é maior. Assim, para um mesmo átomo, temos: 1ª E.I. < 2ª E.I. < 3ª E.I. Afinidade eletrônica ou eletroafinidade É a energia liberada quando um átomo isolado, no estado gasoso, “captura” um elétron. X0(g) + e– → X–(g) + energia Generalizando: Numa família ou num período, quanto menor o raio, maior a afinidade eletrônica. Aula 6 Página 1 Eletronegatividade É a força de atração exercida sobre os elétrons de uma ligação. A eletronegatividade dos elementos não é uma grandeza absoluta, mas, sim, relativa. Ao estudá-la, na verdade estamos comparando a força de atração exercida pelos átomos sobre os elétrons de uma ligação. Essa força de atração tem relação com o raio atômico: quanto menor o tamanho do átomo, maior será a força de atração, pois a distância núcleo-elétron da ligação é menor. A eletronegatividade não é definida para os gases nobres. As variações de eletronegatividade podem ser representadas pela ilustração a seguir: Na tabela periódica, a eletronegatividade cresce de baixo para cima e da esquerda para a direita. A eletronegatividade relaciona-se com o raio atômico: de maneira geral, quanto menor o tamanho de um átomo, maior será a força de atração sobre os elétrons. EXERCÍCIOS DE CLASSE 1. (FUVEST) – O gráfico mostra a variação do potencial de ionização para elementos com número atômico (Z) de 1 a 19. a) Dê o nome dos três elementos que têm maior dificuldade de formar cátions, no estado gasoso. b) Explique por que, no intervalo de Z = 3 a Z = 10, o potencial de ionização tende a crescer com o aumento do número atômico. 2. (UNESP 2009) – Os átomos dos elementos X, Y e Z apresentam as seguintes configurações eletrônicas no seu estado fundamental: 2 2 5 X → 1s 2s 2p 2 2 6 1 Y → 1s 2s 2p 3s 2 2 6 2 6 10 2 5 Z → 1s 2s 2p 3s 3p 3d 4s 4p É correto afirmar que: a) dentre os citados, o átomo do elemento X tem o maior raio atômico. b) o elemento Y é um metal alcalino e o elemento Z é um halogênio. c) dentre os citados, o átomo do elemento Z tem a maior afinidade eletrônica. d) o potencial de ionização do elemento X é menor do que o do átomo do elemento Z. e) o elemento Z pertence ao grupo 15 (VA) e está no quarto período da classificação periódica. 3. (UFRJ) – Um professor decidiu decorar seu laboratório com um "relógio de Química" no qual, no lugar das horas, estivessem alguns elementos, dispostos de acordo com seus respectivos números atômicos, como mostra a figura. Indique a hora que o relógio do professor marca quando: a) o ponteiro dos minutos aponta para o elemento de menor número atômico e o ponteiro das horas aponta para o elemento mais eletronegativo. b) O ponteiro dos minutos aponta para o metal alcalino terroso de menor raio atômico e o ponteiro das horas aponta para o gás nobre do segundo período. Aula 6 Página 2 4. (ITA) – Em relação ao tamanho de átomos e íons, são feitas as afirmações seguintes: I. O Cℓ-(g) é menor do que o Cℓ(g) II. O Na+(g) é menor do que o Na(g) 2+ 2+ III. O Ca (g) é maior do que o Mg (g) IV. O Cℓ(g) é maior do que o Br(g) Das afirmações anteriores, estão corretas apenas: a) II. b) I e II. c) II e III. d) I, III e IV. e) II, III e IV. EXERCÍCIOS COMPLEMENTARES 1. (UNIFESP 2009) – O gráfico apresenta as primeiras e segundas energias de ionização (1 EI e 2 EI) para os elementos sódio, magnésio e cálcio, indicados como I, II e III, não necessariamente nessa ordem. Dentre esses elementos, aqueles que apresentam os maiores valores para a primeira e para a segunda energia de ionização são, respectivamente, a) cálcio e magnésio. b) cálcio e sódio. c) magnésio e cálcio. d) magnésio e sódio. e) sódio e magnésio. 2. (FGV) – A tabela apresenta três propriedades relacionadas a três elementos. Propriedades Elementos X (pm) Y (kJ/mol) Z (pm) Magnésio 160 736 72 Cálcio 197 590 100 Cloro 99 1255 181 As propriedades X, Y e Z correspondem, respectivamente, a a) raio atômico, primeira energia de ionização e raio iônico. b) raio atômico, eletronegatividade e afinidade eletrônica. c) raio iônico, afinidade eletrônica e raio atômico. d) raio iônico, primeira energia de ionização e raio atômico. e) eletronegatividade, raio atômico e afinidade eletrônica. 3. (UNIFESP) – Na tabela a seguir, é reproduzido um trecho da classificação periódica dos elementos. A partir da análise das propriedades dos elementos, está correto afirmar que a) a afinidade eletrônica do neônio é maior que a do flúor. b) o fósforo apresenta maior condutividade elétrica que o alumínio. c) o nitrogênio é mais eletronegativo que o fósforo. d) a primeira energia de ionização do argônio é menor que a do cloro. e) o raio do íon Aℓ3+ é maior que o do íon Se2-. Aula 6 Página 3 4. (FGV) – A figura apresenta uma parte da tabela periódica: Dentre os elementos considerados, aquele que apresenta átomo com maior raio atômico e aquele que apresenta a primeira energia de ionização mais alta são, respectivamente, a) Ge e O. b) Ge e Br. c) Br e Se. d) P e C. e) C e Se. 5. (ITA) – Qual das opções abaixo apresenta a comparação ERRADA relativa aos raios de átomos e de íons? a) raio do Na+ < raio do Na. + b) raio do Na < raio do F . 2+ 2c) raio do Mg < raio do O . 2d) raio do F < raio do O . 2+ e) raio do F < raio do Mg . Aula 6 Página 4
Download