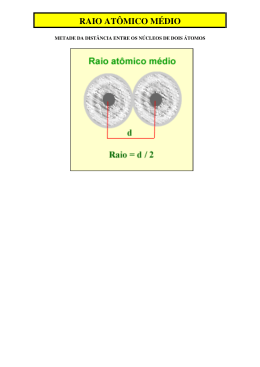
Frente A Módulo 06 Propriedades Periódicas Carga Nuclear Efetiva Força de atração entre o núcleo e os elétrons externos Zef = Z - S Z = número de prótons no núcleo (número de elétrons) S = número de elétrons internos elétrons entre o núcleo e o elétron externo Tamanho de átomos e íons O raio atômico dos gases nobres é a distância do centro do núcleo até a camada de valência (último nível de energia) Para outros átomos calcula-se o raio atômico médio, que é o resultado da divisão da medida entre dois núcleos por dois. Raio Atômico • No mesmo período, à medida que o número atômico aumenta, o raio atômico diminui, pois quanto maior for o número atômico, maior será a força de atração do núcleo com os elétrons, o que faz com que eles fiquem mais “juntos”, tendo, portanto, menor raio. • Mesma coluna: o período indica a quantidade de níveis que os átomos de um elemento possuem. Portanto, quanto maior for a quantidade de níveis, maior será o seu raio. • Cátions : perde elétrons, seu núcleo atrai mais fortemente a eletrosfera, diminuindo o raio • Ânions: ganha elétron, as repulsões eletrostáticas aumenta, aumentando o raio Raio do cátion < Raio do átomo neutro < Raio do ânion • Espécies Isoeletrônicas: íons e átomos isoeletrônicos possuem o mesmo número de níveis preenchidos e de elétrons. Maior número atômico, menor raio. Exemplo: Na+ (Z = 11) e F- (Z = 9) Energia de Ionização • É a energia mínima necessária para se retirar o último elétron de um átomo isolado e no estado gasoso. E(g) + Energia E+ (g) + eEnergia de Ionização Afinidade Eletrônica • Quando um átomo neutro e no estado gasoso recebe um elétron, ele se torna um ânion e emite energia. Essa energia emitida é denominada afinidade eletrônica. Eletronegatividade • É uma propriedade que mede a tendência que o elemento possui de atrair elétrons para si. Lembre-se: não se define eletronegatividade para gases nobres Eletropositividade • É a medida da tendência de um átomo em perder elétrons numa ligação química. Volume atômico • É o volume ocupado por um mol de átomos do elemento no estado sólido. É calculado dividindo-se a massa molar de um elemento pela sua densidade. Densidade ou Massa Específica • É a razão entre a massa de um elemento e seu volume. Temperatura de Fusão e Ebulição • Os pontos de fusão e ebulição variam de acordo com a densidade, exceto nas famílias dos metais alcalinos e dos alcalinos terrosos.
Download