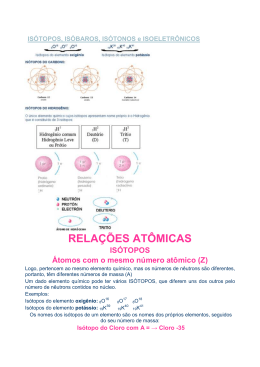
Química 2 – Prof. Willame O que há dentro do Átomo? 1- Coloque V ou F nas afirmações acerca do átomo e das suas partículas: ( V ) A maior parte da massa do átomo está concentrada no núcleo. ( F ) Um átomo neutro deve possui necessariamente o mesmo número de prótons e de nêutrons. ( V ) Em um íon, o número de prótons deve ser necessariamente diferente do número de elétrons. ( F ) Nêutrons e elétrons possuem massas praticamente iguais. 2- A partir dos dados fornecidos, calcule o número de prótons, nêutrons e elétrons dos átomos ou íons baixo. a) b) 88 38 79 34 Sr Se 2+ 2− p+ = 38 n0 = 50 e- = 36 p+ = 34 n0 = 45 e- = 36 c) d) 59 28 197 79 Ni Au + p+ = 28 n0 = 31 e- = 28 p+ = 79 n0 = 118 e- = 78 3- Complete o quadro a seguir com as informações que estão faltando: p+ n0 e- Z A 8 8 10 8 16 25 30 25 25 55 38 50 36 38 88 Ne 10 17 10 10 27 1- 53 74 54 53 127 Átomo/Íon O 2- Mn Sr I 2+ Cap. 29, 31 e 32 4- Considere o conjunto de átomos: 57 27 58 28 A B 58 26 56 28 C D 57 25 E 59 27 58 25 F G a) Quais pertencem ao mesmo elemento químico? A e F // B e D // E e F b) Quais são isótopos? A e F // B e D // E e F c) Quais são isóbaros? A e E // B, C e G d) Quais são isótonos? A e B // C, E e F 5- Considere estes valores, referentes à quantidade de partículas de três átomos A, B e C: Átomo Prótons Nêutrons Elétrons Número de massa (A) A X = 19 20 Z = 19 39 B Y = 20 20 20 M = 40 C 20 19 W = 20 V = 39 Determine: a) Os valores de x, y, z, w, m e v. b) Os átomos isótopos e os isóbaros. Resposta: Isótopos (B e C), Isóbaros (A e C) 6- Um átomo neutro tem 72 prótons e 62 nêutrons no núcleo. Qual o seu número atômico (Z), número de massa (A) e número de elétrons em sua eletrosfera? Z = 72, A = 134 e elétrons = 72. 241 7- Quantos nêutrons deve ter o átomo de Z = 92 para que ele seja isóbaro do átomo 93 92X241 8- O átomo X é isóbaro do 40 20Ca e isótopo do 18Ar 36. Np ? → n = 149 Indique o número de nêutrons do átomo X. 18X40 → n = 22 9- Um átomo neutro possui número atômico (3x—1) e número de massa (5x+4). Sabendo que seu número de nêutrons é igual a 15, calcule o valor de x e o seu número de prótons. 3x-1X5x+4 → n = 15 Z = 3x-1 5x+4 = 3x-1+15 Z = 15 – 1 2x = 10 Z = 14 x=5 10- Abundância relativas dos isótopos do boro 10B = 20 % e 11B = 80 %. (B Z = 5) Determine: a) Quantidade de elétrons, prótons e neutrons de cada isotopo do boro. 5B10 (20 %) p+ = 5 n0 = 5 e- = 5 5B11 (80 %) p+ = 5 n0 = 6 e- = 5 b) A massa atõmica do boro. MA (Boro) = (10 . 20 + 11 . 80) / 100 MA (Boro) = (200 + 880) / 100 MA (Boro) = (1080) / 100 MA (Boro) = 10,80 11- Considere três átomos, A, B e C, cujos números atômicos sejam, respectivamente 3x+4, 4x-1 e 2x+10. Encontre seus números atômicos e de massa, sabendo que: • Os íons A+ e C2+ são isoeletrônicos; • A e C são isótonos; • B e C são isóbaros; • O números de massa de A é 39. 3x+4 A 39 4x-1 B A 2x+10 50 30 C A A+ e-=3 x + 4 ( - 1) e-=3x + 3 C 2+ e-=2 x + 10 ( -2) e-=2 x + 8 São isoeletrônicos 3x + 3 = 2x + 8 x=8–3 x=5 São isótonos 19 A 39 → n = 20 30 C A n = 20 São isóbaros 30 C A = 50 → 19 B A = 50 n = 20 19 A 39 19 B C 50
Download