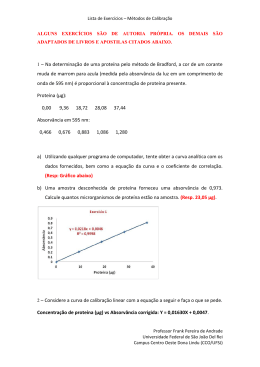
Lista de Exercícios – Métodos de Calibração ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 – Na determinação de uma proteína pelo método de Bradford, a cor de um corante muda de marrom para azula (medida pela absorvância da luz em um comprimento de onda de 595 nm) é proporcional à concentração de proteína presente. Proteína (µg): 0,00 9,36 18,72 28,08 37,44 Absorvância em 595 nm: 0,000 0,210 0,417 0,620 0,814 a) Utilizando qualquer programa de computador, tente obter a curva analítica com os dados fornecidos, bem como a equação da curva e o coeficiente de correlação. (Resp: Gráfico abaixo) b) Uma amostra desconhecida de proteína forneceu uma absorvância corrigida de 0,507. Calcule quantos microgramas de proteína estão na amostra. (Resp. 23,05 µg). 2 – Considere a curva de calibração linear com a equação a seguir e faça o que se pede. Concentração de proteína (µg) vs Absorvância corrigida: Y = 0,01630X + 0,0047. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração a) Suponha que foram encontrados valores de absorvância de 0,265; 0,269; 0,272 e 0,258 para quatro amostra idênticas de uma amostra desconhecidas e absorvância de 0,099, 0,091, 0,101 e 0,097 para quatro brancos. Determine a quantidade de proteína na amostra desconhecida. (Resp. = 10,08 µg). 3 – Uma amostra desconhecida de Cu2+ apresentou uma absorvância de 0,262 em uma análise de absorção atômica. Então, 1,00 ml de uma solução contendo 100,0 ppm (= µg/mL) de Cu²+ foi misturada com 95,0 mL da amostra desconhecida, e a mistura foi diluída a 100,0 mL em um balão volumétrico. A absorvância da nova solução foi de 0,500. Determine [Cu²+] na amostra desconhecida. (Resp. 1,04 ppm). 4 – Uma amostra desconhecida de Ni²+ fornece uma corrente de 2,36 µA em uma análise eletroquímica. Quando 0,500 mL de solução de Ni²+ 0,0287 M são adicionados a 25,0 ml da amostra desconhecida, a corrente aumenta para 3,79 µA. Encontre [Ni²+] na amostra desconhecida. (Resp. 8,986 x 10-4 M). 5 – Uma solução contendo X a 3,47 mM (analito) e S a 1,72 mM (padrão interno) apresentou, em uma análise cromatográfica, picos de área igual a 3473 e 10.222, respectivamente. Então, 1,00 mL de uma solução 8,47 mM de S foi adicionado a 5,00 mL da amostra desconhecida de X, e a mistura foi diluída a 10,0 mL. Essa solução apresentou picos de área igual a 5428 e 4431 para X e S, respectivamente. Determine a concentração de X na amostra original. (Resp. 12,36 mM). 6 – Os dados que seguem representam áreas relativas de picos obtidas para cromatogramas de soluções padrão de metilvinilcetona (MVC). Concentração de MVC, mmol/L Área Relativa de Pico 0,500 3,76 1,50 9,16 2,50 15,03 3,50 20,42 4,50 25,33 5,50 31,97 Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração a) Utilizando qualquer programa de computador, obtenha a melhor curva analítica com os dados fornecidos, bem como a equação da curva e o coeficiente de correlação. (Resp: Gráfico abaixo) b) Uma amostra contendo MVC gerou uma área relativa de pico de 10,3. Calcule a concentração de MVC nessa solução. (Resp. 1,69 mM). 7 – Um técnico de análises clínicas determinou Pb em duas amostras de cabelo de pacientes expostos a tintas. Para determinação, 0,25 mg de cada cabelo foi digerido em forno microondas e o volume final foi ajustado para 25 mL. A determinação foi realizada por GF AAS e os resultados da leitura do equipamento encontram-se na tabela abaixo. Também foi utilizada uma amostra de branco real que passou pelo mesmo procedimento até a determinação do analito, cujas leituras se encontram na tabela abaixo. Em seguida, o analista enviou os resultados para o farmacêutico responsável para que ele gerasse o laudo. Amostra Absorvância Amostra Absorvância Curva Analítica Branco 1 0,025 Branco 7 0,024 Y = 0,002 + 0,00291X Branco 2 0,037 Branco 8 0,015 Faixa Linear Branco 3 0,012 Branco 9 0,041 LQ a 60 µg/mL Branco 4 0,029 Branco 10 0,019 Branco 5 0,048 Paciente 1 (n=3) 0,035 Branco 6 0,026 Paciente 2 (n=3) 0,15 Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração Se você fosse o farmacêutico, como você expressaria os resultados de cada paciente? Considere os seguintes dados: Teor de Pb Indicativo Até 100 mg/g Normal De 100 a 1000 mg/g Em observação > 1000 mg/g Crítico Resp. Paciente 1: Teor de Pb < LD e LQ; Paciente 2: Teor de Pb = 4124 mg/g (Paciente com níveis críticos de Pb). Exercícios Adaptados do Skoog – Capítulo 8 8-13. A concentração do íon sulfato em águas naturais pode ser determinada pela medida da turbidez que resulta quando um excesso de BaCl 2 é adicionado a uma quantidade medida da amostra. Um turbidímetro, instrumento usado para essa análise, foi calibrado com uma série de padrões de soluções padrão de Na2SO4. Os seguintes dados foram obtidos na calibração: SO42– mg L–, Cx Leitura do Turbidímetro, R. 0,00 0,06 a) Construa um gráfico de Concentração de SO42– vs Leitura e calcule a inclinação e o intercepto 5,00 1,48 10,0 2,28 15,0 3,98 20,0 4,61 pelo método dos mínimos quadrados. b) Obtenha a concentração de sulfato em uma amostra que gerou uma leitura de 2,84 no turbidímetro. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração 8-14. Os dados que seguem foram obtidos em uma calibração de um eletrodo íonseletivo sensível a cálcio empregado para a determinação de pCa. Sabe-se que existe uma relação linear entre o potencial e pCa. pCa = – log [Ca2+] E. mV 5,0 – 53,8 4,0 – 27,7 a) Construa um gráfico de pCa vs E, mV e calcule a inclinação e o intercepto pelo método dos mínimos quadrados. b) Calcule pCa de uma solução de soro na qual o 3,0 + 2,7 2,0 + 31,9 1,0 + 65,1 potencial medido do eletrodo foi de 10,7 mV 8-15. Os dados que seguem representam áreas relativas de picos obtidas para cromatogramas de soluções padrão de metilvinilcetona (MVC). Concentração de MVC, mmol/L Área Relativa de Pico a) Construa Concentração um de gráfico MVC vs de Área relativa de Pico e calcule a inclinação 0,50 3,76 1,50 9,16 2,50 15,03 3,50 20,42 em uma amostra A que gerou uma 4,50 25,33 área relativa de pico de 10,3 e de 5,50 31,97 e o intercepto pelo método dos mínimos quadrados. b) Obtenha a concentração de MVC uma amostra B que gerou uma área de 22,8. 8-16. Os dados na tabela que segue foram obtidos durante uma determinação colorimétrica de glicose em soro sanguíneo. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração Concentração de Glicose, mmol/L Absorbância a) Construa Concentração um gráfico de de Glicose vs Absorbância e calcule a inclinação e 0,0 0,002 2,0 0,150 4,0 0,294 6,0 0,434 8,0 0,570 em uma amostra cuja absorbância foi 10,0 0,704 de 0,350. o intercepto pelo método dos mínimos quadrados. b) Obtenha a concentração de glicose 8-17. Os dados na tabela a seguir representam o potencial de eletro E versus a concentração c de uma espécie de interesse. E, mV Concentração c em mol L-1 a) Construa um gráfico de – log de Concentração da espécie de interesse 106 0,20000 115 0,07940 121 0,06310 quadrados. 139 0,03160 b) 153 0,02000 espécie de interesse em uma amostra 158 0,01260 174 0,00794 182 0,00631 187 0,00398 211 0,00200 220 0,00126 226 0,00100 vs E, mV e calcule a inclinação e o intercepto pelo método dos mínimos Obtenha a concentração da cujo E foi de 155 mV. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração 8-20. O potássio pode ser determinado por espectrometria de emissão em chama (fotometria de chama) usando um padrão interno de lítio. Os seguintes dados foram obtidos para soluções padrão de KCl e uma solução desconhecida contendo uma quantidade constante de LiCl como padrão interno. Todas as intensidades foram corrigidas pela subtração da intensidade de emissão do branco. Concentração de Intensidade de Emissão Intensidade de Emissão K, ppm de K de Li 1,0 10,0 10,0 2,0 15,3 7,5 5,0 34,7 6,8 7,5 65,2 8,5 10 95,8 10,0 20 110,2 5,8 Amostra 47,3 9,1 a) Construa um gráfico de intensidade de emissão de K versus concentração de K e calcule a inclinação e o intercepto pelo método dos mínimos quadrados. b) Construa um gráfico de intensidade de emissão de K e da intensidade de emissão de Li versus concentração de K e compare os parâmetros da curva calculados no item anterior. c) Calcule a concentração de potássio na amostra. Considere uma concentração de Li+ = 1,0 ppm. 8-21. O cobre foi determinado em uma amostra de água de rio por espectrometria de absorção atômica e pelo método das adições de padrão. Para a adição, 100,0 µL de uma solução de 1.000,0 µg/mL de um padrão de cobre foram adicionados a 100,0 mL de solução. Os seguintes dados foram obtidos: Absorbância do branco do reagente = 0,020 Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ) Lista de Exercícios – Métodos de Calibração Absorbância da amostra = 0,520 Absorbância da amostra mais adição – branco = 1,020 a) Calcule a concentração de cobre na amostra. b) Estudos posteriores mostraram que o branco do reagente usado para obter esses dados foi inadequado e que a real absorbância do branco era de 0,100. Encontre a concentração de cobre utilizando o branco apropriado e determine o erro provocado pelo uso de um branco inadequado. 8-22. O método das adições de padrão foi empregado para determinar o nitrito em uma amostra de solo. Uma alíquota de 1,00 mL da amostra foi misturada com 24,00 mL de um reagente colorimétrico e o nitrito foi convertido para um produto colorido com uma absorbância corrigida pelo branco de 0,300. Para 50,00 mL da amostra original, 1,00 mL da solução padrão de 1,00 x 10-3 mol L-1 de nitrito foi adicionado. O mesmo procedimento de formação do composto colorido foi seguido e a nova absorbância foi de 0,530. Qual a concentração de nitrito na amostra original? DADOS Y = mx + b Referências 1. Harris, D. C. Análise Química Quantitativa. 6ª ed. LTC – Livros Técnicos e Científicos Editora, Rio de Janeiro, 2005. 2. Skoog, D. A.; West, D. M.; Holler, F. J.; Crouch, S. R. Fundamentos de Química Analítica. 8ª ed. Pioneira Thomson Learning, São Paulo, 2006. Professor Frank Pereira de Andrade Universidade Federal de São João Del Rei Campus Centro Oeste Dona Lindu (CCO/UFSJ)
Download