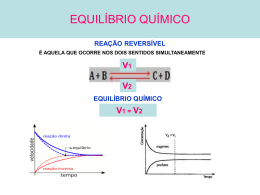
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa ocorrem simultaneamente. Essas reações são chamadas de reversíveis e é representada por ou . Dizemos que esses sistemas estão em equilíbrio. Exemplos de sistemas em equilíbrio. • Ex.1: Água líquida contida em um frasco fechado. Quando a velocidade de vaporização se iguala à de condensação, dizemos que o sistema atingiu o equilíbrio. Equilíbrio Químico • As reações químicas, assim como as mudanças de fases, são reversíveis. • Haverá condições de concentração e temperatura sob as quais reagentes e produtos coexistem em equilíbrio. Hb + O2 HbO2 No equílibrio a formação da HbO2 é igual a velocidade de “decomposição” em Hb e O2. Representação gráfica do equilíbrio: Natureza Dinâmica A primeira característica do estado de equílibrio é ser dinâmico; trata-se de uma situação permanente mantida pela igualdade de velocidades de duas reações químicas opostas. Espontaneidade A segunda generalização é que o sistema tendem a atingir um estado de equilíbrio. O equilíbrio só será deslocado por alguma influência externa, e uma vez deixado a si próprio, o sistema perturbado voltará ao normal. Reversibilidade A terceira generalização é que a natureza e as propriedades do equilíbrio são iguais, não importa a direção a partir da qual ele é atingido. Natureza Termodinâmica A quarta generalização diz que o estado do equilíbrio representa um meio-termo entre duas tendências opostas: a propensão das moléculas a assumir estado de energia mínima e o ímpeto das moléculas assumir um estado de máxima entropia. Ex: CaCO3 (s) CaO (s) + CO2(g) Estado sólido Altamente ordenado Alta entropia no estado gasoso. Constante de Equilíbrio em termos de concentração O cálculo da constante de equilíbrio foi formulado pela primeira vez pelos norueguês Guldberg e Waage em 1963 e enunciado como a lei de ação das massas. aA + bB c C + d D a expressão da constante de equilíbrio (Kc) é dada por : Kc= [C] c [D]d [A] a [B]b Veja dois exemplos de representação do Kc em equilíbrio homogêneos: I. 2 SO3 (g) 2SO2 (g) + O2 (g) I. Kc= [SO2 ] 2 [O2] [SO3] 2 II. H2 (g)+ I2 (g) 2HI (g) II. Kc= [HI ] 2 [H2] [I2] Expressão da constante de equilíbrio A expressão da constante de equilíbrio (Kc) é dada por : aA + bB c C + d D a expressão da constante de equilíbrio (Kc) é dada por : Kc= [C] c [D]d [A] a [B]b Participantes sólidos não devem ser representados na expressão da constante de equilíbrio (Kc),pois suas concentrações são sempre constantes. Equilíbrios em meio aquoso, a água líquida, H2O (l) , não fará parte da expressão da constante de equilíbrio. Veja dois exemplos de representação do Kc em equilíbrio homogêneos: I. C(s) + O2 (g) CO2 (g) IIC12H22O11(aq) + H2O (l) C6H12O6(aq) + C6H12O6(aq) Sacarose I. Kc= [CO2] [O2] glicose II. Kc = [C6H12O6] [C6H12O6] [C12H22O11] frutose Interpretação do valor de Kc e extensão da reação Considere as seguintes situações de equilíbrio e as respectivas constantes: I. 2NO(g) + O2 (g) 2 NO2 (g) Kc= 6,45. 105 II. N2 (g) + H2 (g) 2 NH3(g) Kc= 2,37. 10-3 Kc > 1 a concentração dos produtos é maior que dos reagentes, reação direta () prevalece sobre a inversa. Kc <1 a concentração dos reagentes é maior que dos produtos, reação inversa () prevalece sobre direta. Quanto maior for o valor de Kc, maior será a extensão da ocorrência da reação direta. Quanto menor o valor de Kc, maior será a extensão da ocorrência da reação inversa. Constante de Equilíbrio em termos de pressão Quando pelo menos um dos participantes do equilíbrio é um gás, a constante de equilíbrio pode ser expressa em termos de pressões parciais dos gases envolvidos, e nesse caso, será representada por Kp. . Assim, as expressões de Kc e Kp para os equilíbrios a seguir são dadas por: I. 2 SO3 (g) 2SO2 (g) + O2 (g) II. C(s) + O2 (g) CO2 (g) I. Kc= [SO2 ] 2 [O2] [SO3] 2 II. Kc= [CO2] [O2] I. Kp= (PSO2)2 (PO2) (PSO3) 2 II. Kp= (PCO2) (PO2) Na expressão de Kp, só deve ser representados os componentes gasosos. Kp= Kc (RT), em que ∆n é a variação de no número de mol. Constante de Ionização Soluções aquosas de ácidos e bases também são encontradas na situação de equilíbrio, que pode ser representada da seguinte forma: Ácidos HA (aq)H + (aq) + A-(aq) Ka= [H+ ] [A-] [HA] Bases c(OH)x (aq) c +x (aq) + x OH- (aq) Kb= [c+x ] [OH-] x [HA] Veja alguns exemplos da ionização de ácidos em água: I.CH3COOH (aq H+ +CH3COOI Ka= [H+ ] [CH3COO -] [CH3COOH] II. HF (aq H+ + FII Ka= [H+ ] [F -] [HF] Quanto maior o Ka, mais forte será ácido, pois este estará mais ionizado. Quanto maior o Kb mais forte será a base, pois esta estará mais ionizada. Constante de Ionização e forças de ácidos Quanto maior o valor da constante de ionização (Ka) Mais ionizado estará o ácido, maior a concentração H+ maior será sua força. Temos os seguintes valores de Ka : CH3COOH Ka= 6,6 . 10-5 HF Ka= 1,8 . 10-4 Comparando os valores de Ka ,podemos dizer que o ácido acético é mais fraco que o ácido fluorídrico, pois possui um valor de Ka menor. Figura do livro: Química Volume único –Usberco Salvador (2002) Constantes de ionização dos ácidos Tabela do livro: Química Volume único –Usberco Salvador (2002) Constante de equilíbrio iônico da Água (Kw) Medidas experimentais de condutibilidade elétrica mostram que água pura, se ioniza numa extensão muito pequena: + KW = [H+ ] [OH-] H2O (l) H+ (aq) + OH-(aq) As concentrações de íons H+ e OH- presentes no equilíbrio variam com a Temperatura, mas serão sempre iguais entre si: Água pura[H+ ] = [OH-] A 25oC, as concentrações em mol/L de H+ e OH- na água pura são iguais entre si e apresentam o valor de 10-7mol/L. Água pura[H+ ] = [OH-]= 10-7mol/L. Substituindo no Kw teremos: KW = [H+ ] [OH-]=10-7. 10-7=10-14 Deslocamento de Equilíbrio Princípio de Le Chatelier Quando um sistema está em equilíbrio, a velocidade da reação direta é igual à velocidade da inversa. Se não ocorrer a ação de nenhum agente externo, ele tende permanecer nessa situação indefinidamente. Porém, se for exercida uma ação externa sobre esse equilíbrio, ele tende reagir de maneira a minimizar os efeitos dessa ação. Esse é o tema do Princípio de Le Chatelier, publicado em 1884: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força.” Fatores que afetam o equilíbrio Concentração O aumento da concentração dos reagentes desloca o equilíbrio para formação dos produtos. () O aumento da concentração dos produtos desloca o equilíbrio para os reagentes (). A remoção de produtos desloca o equilíbrio para formação dos produtos, ou seja reação direta (). Exemplo: Considere o seguinte equilíbrio: C(s) + CO2 (g) CO(g) 1º situação- Adição de CO 2(g) Com o aumento do CO 2 há o aumento de choques de C(s) e o CO 2 . Isso favorece a formação do CO(g). 2º situação- Adição de CO (g) Com o aumento do CO 2 ocorre um aumento na concentra~]ap dos composto, transformando-o parcialmente em C(s) e o CO 2. O equilíbrio desloca para esquerda. (). 3º situação- Remoção de CO (g) Quando retiramos parte do CO presente no equilíbrio, imeditamente ocorre uma diminuição na concentração do composto, como consequência, a velocidade da reação inversa diminui, favorecendo a fomração do CO, ou seja equilíbrio desloca para direita (). Pressão Quando aumentamos a pressão sobre um equilíbrio gasoso, à temperatura constante, ele desloca no sentido da reação capaz de diminuir esse aumento da pressão e vice-versa. Provoca a contração do volume Aumento de pressão Provoca a expansão do volume Diminuição de pressão 2SO2(s) + O2 (g) 2 SO3(g) 3mol 3 volume 2mol 2 volume o equilíbrio desloca para o lado de menor volume (menor no de mol) o equilíbrio desloca para o lado de maior volume (maior no de mol) Temperatura A temperatura, além de provocar deslocamento do equilíbrio, é único fator responsável por alterações na constante de equilíbrio (Kc). Aumento da temperatura Diminuição da temperatura Desloca o equilíbrio no sentido da reação endotérmica (absorção de calor) Desloca o equilíbrio no sentido da reação exotérmica (liberação calor) Exemplo: N2(s) + 3 H2 (g) 2 NH3(g) ∆H<0 (reação exotérmica) Aumento da temperatura favorece a degradação da amônia (NH3) Aumento da temperatura favorece a formação da amônia (NH3) Efeitos dos Caralisadores sobre o equilíbrio Catalisadores são substâncias que aumentam a velocidade das reações químicas pela diminuição da energia da ativação. Catalisadores não alteram o equilíbrio. Os catalisadores apenas diminuem o tempo necessário para que a reação atinja o equilíbrio.
Download