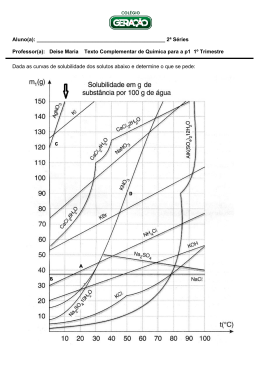
Colégio Liceal de Santa Maria de Lamas Cursos Profissionais – 11º ano – 2012/2013 Disciplina: Física e Química Matriz do exame ao Módulo Q2 Módulo Q2- “Soluções” Competências Visadas Modalidade: prova escrita Conteúdos Época de julho Ú Duração da prova – 90 minutos Objetivos de aprendizagem Dispersões • Recolher, registar e organizar dados de observações (quantitativos e qualitativos) de fontes diversas, Nomeadamente em forma gráfica; Disperso e dispersante • Associar dispersão a uma mistura de duas ou mais substâncias em que as partículas de uma fase dispersa se encontram distribuídas no seio da fase dispersante. Dispersão sólida, líquida e gasosa • Associar a classificação de dispersão sólida, líquida ou gasosa ao estado de agregação do dispersante Critérios para a Classificação de dispersões em soluções, colóides e suspensões • Classificar as dispersões em soluções, colóides e suspensões, em função das dimensões médias das partículas do disperso • Identificar solução como a dispersão com partículas do disperso de menor dimensão e suspensão como a dispersão com partículas do disperso de maior dimensão. Soluções Composição qualitativa de soluções • Analisar dados recolhidos à luz de um determinado modelo ou quadro teórico; Matriz Exame • Associar solução à mistura homogénea de duas ou mais substâncias (solvente e soluto(s)). • Classificar as soluções em sólidas, líquidas e gasosas, de acordo com o estado físico que apresentam à temperatura ambiente, exemplificando. • Associar solvente ao componente da mistura que apresenta o mesmo estado físico da solução ou o componente com maior quantidade de substância presente. • Associar solubilidade de um soluto num solvente, a uma determinada temperatura, à quantidade máxima de soluto que é possível dissolver numa certa quantidade de solvente. • Definir solução não saturada, a uma determinada temperatura, como aquela solução em que, ao adicionar um pouco mais de soluto, este se dissolve, após agitação. • Definir solução saturada, a uma determinada temperatura, como aquela solução em que, ao adicionar um pouco mais de soluto, este não se dissolve, mesmo após agitação. • Definir solução sobressaturada, a uma determinada temperatura, como aquela solução cuja concentração é superior à concentração de saturação, não havendo sólido precipitado. • Referir que, para a maior parte dos compostos, o processo de solubilização em água é um processo endotérmico, salientando que existem, no entanto, alguns compostos cuja solubilidade diminui com a temperatura. • Relacionar o conhecimento científico de soluções e solubilidade com aplicações do dia a dia. • Relacionar a qualidade de uma água com a variedade de substâncias dissolvidas e respectiva concentração. • Interpretar gráficos de variação de solubilidade em água de solutos sólidos e gasosos, em função da temperatura. • Identificar, em gráficos de variação de solubilidade em função da temperatura, se uma solução é não saturada, saturada ou sobressaturada. • Relacionar o aumento da temperatura da água de um rio, num determinado local de descarga de efluentes, com a diminuição da quantidade de oxigénio dissolvido na água e consequentes problemas ambientais. Disciplina: Física e Química Cursos Profissionais – 11º ano – 2012/2013 Módulo Q2- “Soluções” Competências Visadas • Interpretar os resultados obtidos e confrontá-los com as hipóteses de partida e/ou com outros de referência, discutindo os limites de validade dos resultados. Conteúdos Composição quantitativa de uma solução – unidades SI e outras. Objetivos de aprendizagem • Identificar quantidade de substância (n) como uma das sete grandezas fundamentais do Sistema Internacional (SI) e cuja unidade é a mole. • Associar massa molar, expressa em gramas por mole, à massa de uma mole de partículas (átomos, moléculas, iões, …) numericamente igual à massa atómica relativa ou à massa molar relativa. • Descrever a composição quantitativa de uma solução em termos de concentração, concentração mássica, percentagens em volume, em massa e em massa/volume, partes por milhão e partes por bilião. • Associar às diferentes maneiras de exprimir composição quantitativa de soluções as unidades correspondentes no Sistema Internacional (SI) e outras mais vulgarmente utilizadas. • Resolver exercícios sobre modos diferentes de exprimir composição quantitativa de soluções e de interconversão de unidades. Factor de diluição • Distinguir solução concentrada de solução diluída em termos da quantidade de soluto por unidade de volume de solução. • Associar factor de diluição à razão entre o volume final da solução e o volume inicial da amostra, ou à razão entre a concentração inicial e a concentração final da solução. • Indicar algumas situações laboratoriais de utilização do factor de diluição para a preparação de soluções Estrutura da Prova Todos os itens são de resposta obrigatória e podem ser do seguinte tipo: escolha múltipla; verdadeiro/falso; resposta aberta, envolvendo cálculos e/ou pedidos de justificação, bem como a representações esquemáticas Os dados necessários à resolução de cada questão serão indicados no enunciado, nos gráficos, nas figuras e nas tabelas. Cotação Critérios de Correção A prova é cotada para 200 pontos Todas as respostas devem estar legíveis e devidamente referenciadas. Caso contrário, é atribuída a cotação de zero pontos à(s) resposta(s) em causa . Se a resolução de uma alínea apresentar erro imputável à resolução de uma alínea anterior será atribuída à alínea em questão, a cotação integral. Erros de cálculo numérico, transcrição incorreta de dados, conversão incorreta de unidades ou ausência de unidades/unidades incorretas no resultado final terá a penalização de um ponto. As cotações parcelares só serão tidas em conta quando a resolução não estiver totalmente correta. Material necessário Matriz Exame Esferográfica de tinta azul ou preta, uma pequena régua., lápis. Calculadora. Não é permitido o uso de corretor Disciplina: Física e Química 2 Cursos Profissionais – 11º ano – 2012/2013 Módulo Q2- “Soluções”
Download