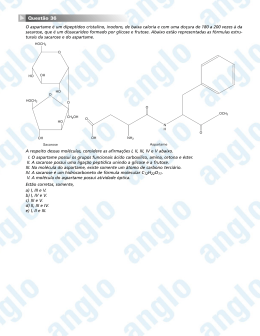
QUÍMICA CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS (com massas atômicas referidas ao isótopo 12 do carbono) 1 18 Fr (223) Ra (226) 1050 Unq Db Rf Série dos Actinídios 180,9 Unp JI Ha W 75 Re 77 Ir 183,6 186,2 190,2 192,2 1060 1070 1080 1090 Unh Rf Sg Uno Hn Hs Uns Bh Ns Une Mt Mt Ag 106,4 107,9 78 79 Pt Au 195,1 197,0 1100 1110 Uun - Cd In 112,4 114,8 80 81 Hg Tb 200,6 Ti 204,4 50 Sn 118,7 82 Ho 207,2 As 74,9 78,9 79,9 51 52 53 Sb Se Te Br I 121,8 127,8 126,9 83 84 85 Bi 209,0 Po Tm (209) At (210) NEÔNIO 35 ARGÔNIO 35,5 34 10 Ar CRIPTÔNIO FLÚOR CLORO Cl 32,1 BROMO OXIGÊNIO ENXOFRE SELÊNIO NITROGÊNIO FÓSFORO CARBONO SILÍCIO Pb S He Ne XENÔNIO Pd 72,6 17 IODO 49 33 TELÚRIO 69,7 48 ÍNDIO 65,4 47 GERMÂNIO GÁLIO ZINCO COBRE 63,5 46 Ge 31,0 19,0 16 ARSÊNIO 102,9 76 Os Rh 58,7 32 P 16,0 ANTIMÔNIO 101,1 45 PRATA Ru 58,9 Ga 28,1 ESTANHO 98,9 44 Zn 31 15 F 2 4,00 RADÔNIO 179 1040 74 Tc 55,8 Cu 27,0 Si 14,0 O ASTATO 89-103 Ta 95,9 43 30 14 N POLÔNIO 88 Hf 73 92,9 Mo 54,9 2B 29 Al 12,0 7 TÚLIO 137,3 87 72 42 Ni 1B 13 C BISMUTO 132,9 Série dos Lantanídios 91 Nb 52,0 Co 28 TÁLIO Ba 57-71 41 Fe 27 12 CÁDMIO 88,9 56 Zr 50,9 26 11 MERCÚRIO 87,6 40 Mn RUTÊNIO Y 47,9 Cr 8B ÓSMIO Sr 39 V TECNÉCIO 45 38 Ti RÊNIO Sc 25 OURO 7B 24 NÍQUEL 6B 23 PALÁDIO 5B 22 10 PLATINA 4B 21 COBALTO 3B 20 9 RÓDIO 24,3 8 IRÍDIO 7 FERRO 6 MANGANÊS 5 CROMO 4 VANÁDIO 3 Mg ALUMÍNIO 10,8 12 Ca B CHUMBO Be TUNGSTÊNIO MOLIBDÊNIO Cs 9 NIÓBIO 55 8 TÉRBIO FRÂNCIO CÉSIO 85,5 6 40,1 ESTRÔNCIO Rb 5 Elementos de transição 4 TANTÁLIO 39,1 37 7A TITÂNIO CÁLCIO K BÁRIO RUBÍDIO POTÁSSIO 19 17 6A ZIRCÔNIO 23,0 16 5A HÁFNIO Na 15 9,01 MAGNÉSIO 11 RÁDIO SÓDIO 6,94 14 4A ESCÂNDIO LÍTIO Li 13 3A HÓLMIO BERÍLIO 3 2 2A BORO H 1,008 HÉLIO 0 1 ÍTRIO HIDROGÊNIO 1A 20,2 18 39,9 36 Kr 83,8 54 Xe 131,3 86 Rn (222) Uuu - 159 163 165 68 Er 167 69 ITÉRBIO 67 ÉRBIO 66 Dy 169 70 Yb 173 71 LUTÉCIO 157 65 Lu LAURÊNCIO 152 64 Gd DISPRÓSIO Pu 150 63 Eu GADOLÍNIO (145) 62 Sm EURÓPIO Np 61 SAMÁRIO 144 Pm PLUTÔNIO U 60 PROMÉCIO Nd NEPTÚNIO 141 NEODÍMIO 59 Pr URÂNIO 140 PRASEODÍMIO CÉRIO 139 58 Ce Lr 175 (244) (243) 96 Cm (247) 97 Bk (247) 98 Cf (251) 99 Es (252) FÉRMIO 95 Am 100 Fm (257) 101 Md (258) NOBÉLIO (237) 94 MENDELÉVIO 238 93 EINSTÊNIO 231 92 CALIFÓRNIO 232 91 Pa BERQUÉLIO (227) 90 Th CÚRIO 89 Ac AMERÍCIO Série dos Actinídios PROTACTÍNIO ( ) = N0 de massa isótopo mais estável 57 La TÓRIO Massa Atômica ACTÍNIO Nome do elemento Símbolo LANTÂNIO Série dos Lantanídios Número Atômico 102 No (259) 103 (260) Abreviaturas: (s) = sólido; (l) = líquido ; (g) = gás; (aq) = aquoso [A] = concentração de A em mol/L. Dados: Constante de Avogadro (NA) = 6 x 1023 R = 0,082 atm . L / K . mol 37. Um estudante pretende separar os componentes de uma amostra contendo três sais de chumbo II: Pb(NO3)2, PbSO4 e PbI2. Após analisar a tabela de solubilidade abaixo, Solubilidade em água Substâncias 16 fria quente Iodeto de chumbo II insolúvel solúvel Nitrato de chumbo II solúvel solúvel Sulfato de chumbo II insolúvel insolúvel ele propôs o seguinte procedimento: "Adicionar água destilada em ebulição à mistura, agitando o sistema vigorosamente. Filtrar a suspensão resultante, ainda quente. Secar o sólido obtido no papel de filtro; este será o sal A. Recolher o filtrado em um béquer, deixando-o esfriar em banho de água e gelo. Proceder a uma nova filtração e secar o sólido obtido no papel de filtro; este será o sal B. Aquecer o segundo filtrado até a evaporação completa da água; o sólido resultante será o sal C." PUC-SP 2002 Os sais A, B, e C são, respectivamente, (A) Pb (NO3)2, Pb SO4 e PbI2. (B) PbI2, PbSO4 e Pb (NO3)2. (C) Pb SO4, Pb (NO3)2 e PbI2. (D) Pb SO4, PbI2 e Pb (NO3)2. 39. O clorato de potássio (KClO3) pode ser decomposto por aquecimento, segundo a equação, (E) Pb (NO3)2, PbI2 e PbSO4. 2 KClO3(s) 38. Analise as propriedades físicas na tabela abaixo: Condução de corrente elétrica amostra A B C D Ponto de fusão 801ºC 43 ºC 1535 ºC 1248 ºC Ponto de ebulição 1413 ºC 182 ºC 2760 ºC 2250 ºC a 25 ºC 1000 ºC isolante condutor isolante condutor condutor isolante isolante → 2 KCl(s) + 3 O2( g) A decomposição de 2,45 g de uma amostra contendo KCIO3 produziu 0,72 g de O2. Considerando que a reação foi completa e que somente o KClO3 reagiu sob o aquecimento, essa amostra contém (A) 100 % de KClO3. (B) 90 % de KClO3. (C) 75 % de KClO3. (D) 60 % de KClO3. (E) 30 % de KClO3. Segundo os modelos de ligação química, A, B, C e D podem ser classificados, respectivamente, como, (A) composto iônico, metal, substância molecular, metal. (B) metal, composto iônico, composto iônico, substância molecular. (C) composto iônico, substância molecular, metal, metal. (D) substância molecular, composto iônico, composto iônico, metal. (E) composto iônico, substância molecular, metal, composto iônico. PUC-SP 2002 40. Um cilindro de 8,2 L de capacidade contém 320 g de gás oxigênio a 27 oC. Um estudante abre a válvula do cilindro deixando escapar o gás até que a pressão seja reduzida para 7,5 atm. Supondo-se que a temperatura permaneça constante, a pressão inicial no cilindro e a massa de gás liberada serão, respectivamente, (A) 30 atm e 240 g. (B) 30 atm e 160 g. (C) 63 atm e 280 g. (D) 2,7 atm e 20 g. (E) 63 atm e 140 g. 17 41. Considere na resolução desse exercício que cada 1g de carboidrato ou de dipeptídeo metabolizado fornece 4 kcal de energia. O aspartame é um adoçante sintético (edulcorante artificial) muito utilizado atualmente por pessoas diabéticas e por aqueles que desejam ter uma dieta menos calórica. A fórmula estrutural do aspartame está representada abaixo. Estão corretas apenas as afirmações: (A) II e IV. (B) I, II e V. (C) I e V. (D) I, III e IV. (E) III e V. 42. Considere as seguintes reações de ionização e suas respectivas constantes: Sobre o aspartame e o seu uso como adoçante foram feitas algumas afirmações: I. O aspartame apresenta as funções amina, amida e ácido carboxílico. II. O aspartame é praticamente insolúvel em etanol. III. O aspartame não é metabolizado pelo organismo e, por isso, as dietas que substituem o açúcar pelo aspartame são menos caloríficas. IV. Uma certa massa de aspartame fornece muito menos energia do que a mesma massa de açúcar. V. O poder edulcorante do aspartame é muito maior do que o do açúcar. Então, para o mesmo efeito, utiliza-se uma quantidade muito menor de aspartame, reduzindo-se o poder calorífico da dieta. 18 H2SO3(l) + H2O(l) Ú H3O+(aq) + HSO3-(aq) Ka = 1 x 10-2 HCO2H(g) + H2O(l) Ú H3O+(aq) + HCO2-(aq) Ka = 2 x 10-4 HCN(g) + H2O(l) Ú H3O+(aq) + CN-(aq) Ka = 4 x 10-10 Ao se prepararem soluções aquosas de concentração 0,01 mol/L dessas três substâncias, pode-se afirmar, sobre os valores de pH dessas soluções que (A) pH H2SO3 < pH HCO2H < 7 < pH HCN (B) pH HCN < pH HCO2H < pH H2SO3 < 7 (C) 7 < pH H2SO3 < pH HCO2H < pH HCN (D) pH H2SO3 < pH HCO2H < pH HCN < 7 (E) pH H2SO3 = pH HCO2H = pH HCN < 7 PUC-SP 2002 43. Uma solução aquosa de peróxido de hidrogênio (H2O2), de concentração 0,1 mol/L, decompõe-se quando em solução alcalina, a 20 oC, segundo a equação. H2O2(aq) Ú H2O(l) + ½ O2(g) O acompanhamento da velocidade de decomposição do peróxido de hidrogênio nessas condições é representado pelo gráfico Analisando os dois gráficos, pode-se afirmar, a respeito da concentração inicial de H2O2 e da temperatura no segundo experimento que (A) [H2O2] inicial = 0,1 mol/L e T = 20 oC (B) [H2O2] inicial = 0,2 mol/L e T > 20 oC (C) [H2O2] inicial = 0,2 mol/L e T = 20 oC (D) [H2O2] inicial = 0,2 mol/L e T < 20 oC (E) [H2O2] inicial = 0,3 mol/L e T > 20 oC 44. Dados: Em um segundo experimento, o acompanhamento cinético da decomposição do H2O2 , nas mesmas condições de pH, resultou no seguinte gráfico. Cd2+ (aq) + 2e- D Cd(s) E°= - 0,40 V Cd(OH)2(s) + 2e- E° = - 0,81 V D Cd(s) + 2 OH-(aq) Ni2+(aq) + 2 e- D Ni(s) E° = - 0,23 V Ni(OH)3(s) + e- D Ni(OH)2(s) + OH-(aq) E° = + 0,49 V As baterias de níquel-cádmio (ni-cad) são leves e recarregáveis, sendo utilizadas em muitos aparelhos portáteis como telefones e câmaras de vídeo. Essas baterias têm como característica o fato de os produtos formados durante a descarga serem insolúveis e ficarem aderidos nos eletrodos, permitindo a recarga quando ligada a uma fonte externa de energia elétrica. Com base no texto e nas semi-reações de redução fornecidas, a equação que melhor representa o processo de descarga de uma bateria de níquel-cádmio é (A) Cd(s) + 2 Ni(OH)3(s) Ú Cd(OH)2(s) + 2 Ni(OH)2(s) (B) Cd(s) + Ni(s) Ú Cd2+(aq) + Ni2+(aq) (C) Cd(OH)2(s) + 2 Ni(OH)2(s) Ú Cd(s) + 2 Ni(OH)3(s) (D) Cd2+(aq) + Ni2+(aq) Ú Cd(s) + Ni(s) (E) Cd(s) + Ni(s) + 2 OH-(aq) Ú Cd (OH)2(s) + Ni2+(aq) PUC-SP 2002 19 45. A ozonólise é uma reação de oxidação de alcenos, em que o agente oxidante é o gás ozônio. Essa reação ocorre na presença de água e zinco metálico, como indica o exemplo H2O + H3C - CH=C - CH3 + O3 Zn H3C - C CH3 O O + H3C - C - CH3 + H2O2 H BIOLOGIA 46.Em vários córregos existentes na periferia de uma cidade, foram encontradas larvas denominadas miracídios. Essas larvas dariam segmento ao 1 se ciclo de vida do verme pudessem se instalar no corpo de um 2 . No trecho acima, as lacunas 1 e 2 devem ser preenchidas correta e, respectivamente, por Considere a ozonólise em presença de zinco e água, do dieno representado a seguir: (A) Ancylostoma duodenale e molusco. CH3 H2O + H3C - CH - CH = C - CH2 - C = CH2 + O3 CH3 (B) Taenia saginata e mamífero. Zn CH3 (C) Schistosoma mansoni e molusco. Assinale a alternativa que apresenta os compostos orgânicos formados durante essa reação. (D) Necator americanus e mamífero. (E) Ascaris lumbricoides e molusco. (A) Metilpropanal, metanal, propanona e etanal. (B) Metilpropanona, metano e 2,4 - pentanodiona. (C) Metilpropanol, metanol e ácido 2,4 - pentanodióico. (D) Metilpropanal, ácido metanóico e 2,4 - pentanodiol. (E) Metilpropanal, metanal e 2,4-pentanodiona. 47. Em uma lagoa de água doce, são encontrados organismos como microcrustáceos (I), que se alimentam de fitoplâncton (II) e são animais predados por insetos aquáticos (III) e também por peixes pequenos (IV). Os insetos, por sua vez, servem de alimento para peixes maiores (V). Através da atividade de certas bactérias (VI) presentes no lago, substâncias orgânicas são degradadas e seus produtos, liberados no ambiente, podem ser reutilizados por todos os organismos. Na tabela abaixo, que letra apresenta correspondência correta com a descrição? Produtores 20 Consumidores Consumidores Consumidores Competidores Primários Secundários Terciários (A) I II III IV V e VI (B) I II III, IV, e V V e VI III e IV (C) II I III, IV e V VI III, IV e V (D) II I III e IV V III e IV (E) VI I II III e IV III, IV e V PUC-SP 2002
Download