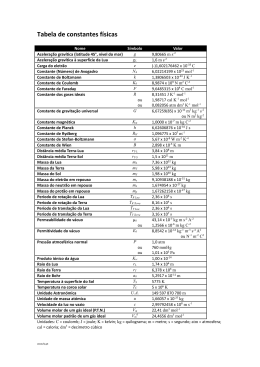
4º Teste de Química (Teste tipo) I Considere o seguinte equilíbrio químico: CO2 (g) + H2 (g) CO (g) + H2O (g) Calcule: a) A constante de equilíbrio a 1000 K. b) Calcule as pressões parciais que cada componente apresentará no equilíbrio se as pressões parciais iniciais no reactor forem de: p(CO2)=0,2 atm; p(H2)=0,3 atm, p(CO)=0,1 atm e p(H2O) = 0,05 atm. c) Calcule, indicando as aproximações que tiver de efectuar, a constante de equilíbrio a 1050 K. II a) Leitos de pedra calcária (CaCO3) são utilizados para corrigir o pH da água em certas nascentes. Diga qual a variação que se pretende obter, e justifique a resposta com base nos diversos equilíbrios envolvidos. III Considere a reação química a seguir indicada a 25ºC: CCl4 (l) + H2 (g) HCl (g) + CHCl3 (l) 1 – Calcule a constante de equilíbrio Kp a 25ºC. 2 – Calcule a variação de energia de Gibbs da reação (∆G ) quando a mistura reacional é formada por 10 atm de H2, 0,1 atm de HCl, 1L de CCl4 e 200mL de CHCl3. Diga se nestas condições a reação é mais ou menos favorável do que nas condições padrão. IV Calcule o pH da solução de hidróxido de cálcio, Ca(OH)2, que obteria se adicionasse 0.1 mole de hidróxido de cálcio, a 1000 ml de água, à temperatura de 25 ºC. ∆dissGo(Ca(OH)2) = 30.24 kJ mol-1 IV Considere a seguinte reacção química: 2N2O5 (g) → 4NO2 (g) + O2 (g) a) Sabendo que a reacção é de 1ª ordem e que a constante de velocidade é 0.35 min-1 a 40 ºC, calcule a concentração de N2O5 e NO2 ao fim de 4 minutos numa experiência em que partiu duma concentração inicial de 0.160 mol/l. b) Quanto tempo será preciso para na experiência da alínea a) a concentração baixar para 0.1 mol/l? c) Se o mecanismo da reação for de 2ª ordem, com a constante de velocidade indicada na alínea a), quanto tempo será necessário para a concentração baixar para 0,1 M? d) Sabendo que a 70 ºC a constante de velocidade passa a ser 0,41 min-1, calcule a energia de ativação. Dados A = 6,022×1023 mol-1; R = 8,314 J K-1 mol-1; R = 0,082 atm l K-1 mol-1 Dados termodinâmicos a 1000 K o -1 -1 ∆fHo (kJmol-1) S (JK mol ) CO2 -394,6 H2 269,3 166,2 CO -112,0 234,6 H2O -247,9 232,7 Dados a 298 K: ∆Hfº (CCl4, l) = -135,44 kJ.mol-1 ∆Hfº (HCl, g) = -92,307 kJ.mol-1 ∆Hfº (CHCl3, l) = -134,47 kJ.mol-1 Sº (CCl4, l) = 216,4 J K-1.mol-1 Sº (HCl, g) = 186,908 J K-1.mol-1 Sº (CHCl3, l) = 201,7 J K-1.mol-1 Sº (H2, g) = 130,684 J K-1.mol-1
Download