P3 - PROVA DE QUÍMICA GERAL - 14/06/08
Nome:
Nº de Matrícula:
GABARITO
Turma:
Assinatura:
Questão
Valor
1a
2,5
2a
2,5
3a
2,5
4a
2,5
Total
10,0
Grau
Revisão
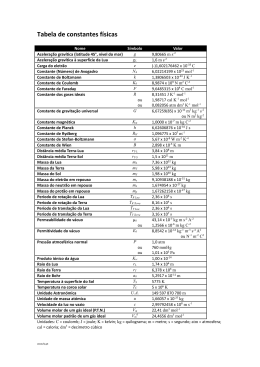
Dados gerais:
U=q+w
1 atm = 760 mmHg
Go = Ho - T So
F = 96500 C mol-1
G° = - n F Eo
1CxV=1J
RT
$E = $E°
lnQ
nF
G = Go + RT ln Q
[A] = [A]0
kt
ln [A] = ln [A]0
kt
1
1
=
+ kt
[A] [A]0
ln
K 2 $H° 1
=
K1
R T1
ln
k 2 Ea 1
=
k1 R T1
1
T2
1
T2
R = 8,314 J mol-1 K-1 = 0,0821 atm L K-1 mol-1
T (K) = T (°C) + 273
1 L atm = 101,3 J
1a Questão:
Considere o processo de sublimação (reação 1) e a reação de dissociação
(reação 2) do iodo e os dados termodinâmicos da tabela apresentados a
seguir:
Sublimação do iodo:
I2(s)
I2(g)
(Reação 1)
Reação de dissociação do iodo:
I2(g)
2I(g)
(Reação 2)
Dados termodinâmicos, a 25 °C:
I2(s)
I2(g)
I(g)
H°f (kJ mol-1)
0
62,4
106,8
S° (J K-1mol-1)
116,1
260,6
180,7
G°f (kJ mol-1)
0
19,4
70,2
a) Calcule a temperatura de sublimação do iodo.
b) Calcule a energia livre padrão,
G°, de dissociação do iodo, a 1500 °C, e
avalie se a quantidade de produto formado aumentará quando a temperatura
for variada de 25 °C para 1500 °C.
c) Calcule a variação de energia interna, U, da reação de dissociação de 0,5
mol de iodo, I2(g), a 1500 °C, sabendo que o rendimento da reação é de 10%.
Resolução:
a) A sublimação, que é um processo de mudança de fase, ocorre em situação
de quase-equilíbrio. Assumindo que não existe modificação significativa nos
valores de H0f e S0, podemos usar os valores da tabela na seguinte equação:
S0 = H0/T ou T = H0/ S0
Onde:
S0 = S0 I2(g) - S0 I2(s) = 260,0 – 116,1 = 143,9 J K-1 mol-1
H0 = H0f I2(g) - H0f I2(s) = 62,4 - 0 = 62,4 kJ mol-1 ou 62.400 J mol-1
Logo:
T = 62.400 J mol-1/ 143,9 J K-1 mol-1 = 433,6 K
b) A 1500 0C ou 1773 K, tem-se:
G0 = H0 - T S0
Onde:
S0 = 2 x S0 I(g) - S0 I2(g) = 2 (180,7) – 260,6 = 100,8 J K-1 mol-1
H0 = 2 x H0f I(g) - H0f I2(g) = 2 (106,8) – 62,4 = 151,2 kJ mol-1 ou 151.20 J
mol-1
Logo:
G0 = H0 - T S0 = 151.200 J mol-1 – 1773 K x 100,8 J K-1 mol-1
G0 = 151.200 – 173.678 = -22.478 J mol-1
A 1500 0C o valor de G0<0 indica que a reação seria espontânea, ao contrário
do que acontece a 25 0C onde o valor de G0>0 (ver abaixo).
G0 = 2 x G0f I(g) - G0f I2(g) = 2 (70,2) – 19,4 = 121 kJ mol-1 ou 121.000 J
mol-1
c) A variação de energia interna depende da quantidade efetiva de I2(g) que se
converteu em I(g), isto é 10% de 0,50 mol de I2(g).
Início
Fim
I2(g)
0,50 mol
0,45
2I(g)
0 mol
0,10 mol
O valor de H0 para dissociação de 1 mol de I2(g) é 151.200 J mol-1, logo, para
0,05 mol tem-se: 0,05 x 151.200 = 7560 J que, na pressão constante, seria o
calor (q) envolvido no processo.
O trabalho seria dado pela expansão (trabalho negativo) do sistema para
manter a pressão constante, ou seja:
W = - nRT = -{(0,45 + 0,10) – 0,50} mol x 8,31 J mol-1 K-1 x 1723 K = -715,9 J
Assim: U = q + W = 7560 – 715,9 = 6.844 J
2a Questão:
O tetróxido de nitrogênio, N2O4, pode ser convertido a dióxido de nitrogênio,
NO2, como representado pela reação abaixo:
N2O4(g)
2NO2(g)
S° = + 175,83 J K-1 mol-1
G° = + 4,73 k J mol-1
a) Calcule a variação de entalpia padrão, ( H°), k J mol-1, em da reação, a
25 °C, dizendo se a mesma é exotérmica ou endotérmica.
b) Calcule a constante de equilíbrio da reação, KP, a 25 °C.
c) Calcule a variação da energia livre, G, da reação, a 25 °C, no momento em
que estão presentes 0,2 mol de N2O4 e 0,8 mol de NO2 em um recipiente de
1,0 L. Qual é a direção espontânea da reação, nestas condições?
Resolução:
a) G°= H° - T S°
25 °C = 298 K
H°= G° + T S°
H° = +4,73 k J mol-1 + 298 K . 175,83 x 10-3 kJ K-1 mol-1
H° = 4,73 + 52,397 =
57,13 k J mol-1
A reação é endotérmica
b) No equilíbrio Q = kp e G = 0
G = G° + RT ln Q
G° = - RT ln kp
1
1
p
==
0
0
1
1
x
x
8
8
4
4
,
,
1
1
kp
k
+ 4,73 J mol-1 x 103
= ln k p = 1,91
8,314 J mol-1 K -1 . 298 K
c) G = ?
G = G° + RT ln Qp
[N2O4] = 0,2 mol L-1
[NO2] = 0,8 mol L-1
PV = n RT
P = Vn RT = [ ]RT
Qp =
(PNO 2 )2
(PN2O 4 )
=
0,8 2 (RT)2
= 3,2 RT
0,2 (RT)
Qp = 3,2 x 0,082 x 298 = 78
Ou
Qp = Qc (RT)
n
= 3,2 (0,082 x 298)1 =78
G = 4,73 + 8,314 x 10-3 x 298 ln 78 = 4,73 + 10,79
G = 15,52 kJ mol -1 >0
Como G é maior do que zero a reação espontânea ocorre no sentido inverso,
ou seja, no sentido da formação do reagente ,nestas condições.
Download