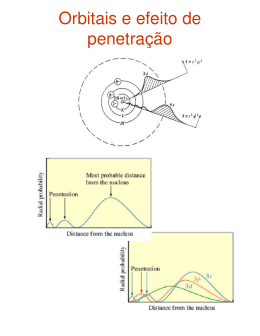
Os elementos de forma organizada a Tabela Periódica mol, massa atômica e molecular Estudando o capitulo 02 aprendemos que apesar da aparência microscópico, as substâncias tem uma organização atômica, no ultimo modelo o de Börh, vimos que era composta de suas sub-partículas prótons e neutros no núcleo, e elétrons na eletrosfera.. O calendário é uma forma de organizar os dias, em um ano sabemos que tem 365 dias um mês tem 30 dias e uma semana 7 dias, porem a forma da semana em linhas, os dias na semana em colunas, foi pensada para evidenciar o máximo de informações da maneira mais concisa possível. Com os elementos como vimos no ponto 2.7 cada um apresenta um número atômico específico, a tabela é organizada por ordem do número atômico. Em 1789, Antoine Lavoisier começou a formular uma lista com elementos químicos, posteriormente, posteriormente outras listas foram elaboradas, tabelas foram propostas, porem da forma como conhecemos hoje, foi pensado principalmento pelo professor de química russo Dmitri Ivanovich Mendeleiev em 1869. O trabalho de Moseley em 1913 serviu para dirimir um erro em que a química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atômica e não pelo número atômico Nesta organização as linhas chamadas de Períodos, os elementos de um mesmo período têm o mesmo número de camadas eletrônicas indo de K até Q. As colunas chamadas de Grupos ou Famílias ,nelas os elementos tem o mesmo numero de elétrons na camada de valência, a ultima camada preenchida mais externa.. Capítulo 03 As Tabelas estão ao nosso redor, organizando os mais variados tipos de informação, no campeonato Paulista de 2014 onde o Ituano foi campeao, na primeira fase eles se encontrava no grupo B O Diagrama de Pauling é uma ferramenta para distribuir os elétrons através da eletrosfera, em átomos e íons. 3 1..2 Histórico Classificação e Estrutura Numero da Coluna Alguns Elementos Nome da Familia 1 (1A) 2 (2A) H Li, Na, K.. Be, Mg, Ca.. (H não é 1A) Metais Alcalinos M. alcalinosTerrosos 3 4 5 6 7 8 B, Al, Ga.. C, Si, Ge.. N, P, As.. O, S, Se.. F, Cl, Br.. He, Ne, Ar, Familia do Boro Famiília do Carbono Familia do Nitrogenio Calcogênios Halogênios Gases Nobres (raros) (3a) (4a) (5a) (6A) (7A) (8A) Sobre a Camada de Valência, em geral, o numero da Colunas, indica quantos eletrons aquele elemento possui na sua ultima camada preenchida. Ex: Sódio 1A 1 elétron Carbono 4A 4 elétrons na ultima camada Cloro 7A 7 elétrons na C.V. Sobre as 18 Colunas, grupos ou Famílias, de elementos, estão dão atenção Uma classificação Antiga: Antes de especial pois apresentam propriedades 2001 as tabelas periódicas eram químicas semelhantes acompanhadas desta diagonal, que seria uma transição entre os Metais e Nesta organização existem 4 Séries químicas,, que são conjuntos de Ametais, apresentando propriedades intermediárias.. elementos: - Elementos representativos: Grupos 1, 2 e dos grupos de 13 a 17. (+ Importantes) - Gases nobres: Grupo 18 - Metais de transição: Grupos de 3 a 12. - Metais de transição interna: Elementos das séries dos lantanídios e dos actinídios. Outra classificação, baseada nas propriedades físicas é a seguinte: - Hidrogênio. (de nenhun grupo) - Ametais (ou não-metais); - Gases nobres; - Metais . Figura: Semimetais em destaque 3 .3 Tendências na tabela Raio atômico A tendência é que no canto inferior esquerdo da tabela tenha os maiores raios atômicos, e os menores no canto superior direito Energia de Ionização Raio Atômico: Metade da distância internuclear ‘’ Quanto maior o raio de um elemento, mais fácil se retira o seu ultimo elétron, ou mais dificilmente ele recebe um elétron ’’ + Os íons são átomos que tiveram o seu numero de elétrons (subparticulas de carga negativa na eletrosfera) alterado. Cation são os compostos que perderam elétrons e ânions compostos que receberam elétrons, porem uma quantidade de energia é necessária no processo. A energia de ionização é a energia necessária para retirar um elétron de um átomo isolado no estado gasoso. + Na Perde e- Na Perde e- Na +2 cátion cátion átomo sódio sódio sódio E I = 496kj/mol E I = 2856kj/mol (Primeiro é) (Segundo é) Cl Perde e- Cl cation átomo Cloro Cloro E I = 1252 kj/mol Acima temos o sódio e o cloro perdendo um elétron, observamos que para o sódio a energia é muito menor, isto indica que o sódio tem uma tendência de perder elétrons mais fácil que o cloro, e ao observarmos a energia para retirar o 2ª eletron do sódio observamos um valor muito maior, pois sempre 2ªEI > 1 ªE I Uma colher de sopa com água Afinidade Eletrônica Afinidade Eletrônica Nesta colher de sopa, se encontra uma quantidade de 9 gramas de água Seria a energia Liberada ao se receber um elétron de um átomo isolado no estado gasoso, assim acompanha a tendência da E.I. pois se um alto valor da E.I indica que o composto não quer receber um elétron, indica que tem a tendência de perder elétrons liberando uma energia maior ao recebe-los, se estabilizando mais ainda. Lembrando que é erroneo dizer que os gases nobres apresentam A.E zero, ao estes elementos ao receberem eletrons terão variação de energia porem em pequenos valores. Eletronegatividade Seria a tendência dos atomos em atrair os elétron para si: H2O, você saberia dizer: F > O > N = Cl > Br > I = S = C > P > H > Metais A) qual a massa atômica do H? e do O ? Resp: 1 e 16 Na tabela periódica é possível encontrar os valores da massa atômica sobre os simbolos dos B) qual a massa molecular do H2O? elementos sua unidade de medida é [ u ] uma unidade arbitrária,. Resp: 1 e 16 C) Na colher existem quantas moléculas Ex: 12C Massa Atômica= 12u 1HMassa Atômica = 1u 16OMassa Atômica = 16u de água? Resp: 1 e 16 A massa molecular, seria a soma da massa total, de todos os átomos da molécula. D) Na colher tem quantos mols de água? 3 4 . Massas atômicas e Massas Moleculares Ex: Glicose Um mol de algumas substâncias S C C6H12O6 Massa Molecular = 6xMcarbono + 12xMhidrogênio + 6xMOxigênio Massa Molecular = 6x 12 + 12x 1 + 6x 16 Massa Molecular = 180u Ex: Gás Carbônico CO2 Massa Molecular = 1 xMcarbono + 2xMOxigênio Massa Molecular = 1x 12 + 2x 16 = 44u 3 .5 Mol e Massa Molar Cu Pb Hg Nestas porções temos: 32g de S - Enxofre 201g de Hg - Mercurio 207g de Pb - Chumbro 64g de Cu - Cobre 12g de C - Carbono O Mol é o nome de uma unidade de grandeza utilizada para substâncias, seria algo equivalente ao cotidiano dúzia, uma unidade de grandeza usada para vários objetos, como 1 dúzia de ovos, meia dúzia de pessoas, 3duzias de carros. Número de Avogadro, ou constante de Avogadro. 23 1 mol = 6,02 x10 Partículas (átomos, íons, moléculas, elétrons) A massa molar de um elemento é a massa de 1 mol de Átomos desse elemento. H 1u 1gramas/mol de átomos CO2 44u 44gramas/mol de moléculas C 12u 12gramas/mol de átomo C6H12O6180u 180gramas/mol de moléculas O 16 u 16gramas/mol de átomos O2) 32 u 32gramas/mol de moléculas
Download