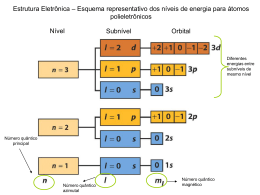
Química Geral Estrutura atômica ORIGEM DA PALAVRA DEMÓCRITO LEUCIPO TODA MATÉRIA É FORMADA POR ÁTOMOS MODELO ATÔMICO DE DALTON ● INDIVISÍVEL, MACIÇO, HOMOGÊNEO ● ÁTOMOS DE UM MESMO ELEMENTO SÃO IDENTICOS ● ÁTOMOS NÃO SÃO CRIADOS , NÃO SÃO DESTRUIDOS , SÃO REARRANJADOS MODELO BOLA DE BILHAR MODELO ATÔMICO DE THOMSON MODELO ATÔMICO DE THOMSON ● DESCOBERTA DO ELÉTRON ( o átomo deixa de ser indivisível) ●O ÁTOMO CONTINUA SENDO MACIÇO E HOMOGÊNEO MODELO PUDIM DE PASSAS MODELO DE RUTHERFORD MACIÇO ? MODELO DE RUTHERFORD RESULTADO DA EXPERIÊNCIA TAMANHAO RELATIVO ENTRE NÚCLEO E ELETROSFERA ÁTOMO SEGUNDO RUTHERFORD ÁTOMO SEGUNDO RUTHERFORD ● DESCOBERTA DO NÚCLEO ● O ÁTOMO DEIXA DE SER MACIÇO E HOMOGÊNEO ● OS ELÉTRONS GIRAM EM TORNO DO NÚCLEO ASSIM COMO OS PLANETA EM TORNO DO SOL MODELO PLANETÁRIO MODELO E BOHR CRITICAS AO MODELO DE RUTHERFORD ● elétrons ao girar de qualquer forma ao redor do núcleo seria atraído pelo núcleo positivo. ● aconteceria a ruptura do núcleo MODELO E BOHR PALAVRAS CHAVES: ● ÓRBITAS ESPECÍFICAS ● ENERGIA QUANTIZADA ● NÍVEIS DISCRETOS DE ENERGIA MODELO DE BHOR NA PRÁTICA ● Os elétrons circulam em órbitas específicas ● Os elétrons nunca perdem sua energia de origem ● Os elétrons podem ganhar energia e saltar para uma camada mais energética ● Os elétrons ao retornarem a camada de origem emitem a energia em forma de luz MODELO DE BHOR NA PRÁTICA APLICAÇÕES DO MODELO DE BHOR FOGOS DE ARTIFICIO FIGURINHAS QUE BRILHAM NO ESCURO GELOUCOS ÁTOMO ATUAL • Elaborado por uma cúpula de cientistas; • Elétron como partícula/onda (dualidade); • Elétrons situados em regiões prováveis da eletrosfera (orbitais); • Átomo divisível; Outros colaboradores p/ o desenvolvimento do modelo atômico atual • 1924 – Luis de Broglie –”O e- se comporta como partícula e onda (dualidade). • 1926 –Schrodinger,princípio da incerteza; • 1931 – Dirac confirmou existência das anti partículas abrindo caminho p/ estudos no campo do teletransporte , holografia , computadores quânticos , supercondutores , e outros ... • 1937 – Confirmação de mais 8 partículas subatômicas . ESTRUTURA ATÔMICA CONCEITOS SOBRE O ÁTOMO ● Número Atômico (Z): quantidades de prótons. Z=p= e (átomo neutro) CONCEITOS SOBRE O ÁTOMO Número de Massa (A): é a soma de prótons e nêutrons A=Z+n Número de Massa (A): a soma das partículas que constitui o átomo. A = Z + n + eA=Z+n n=A-Z REPRESENTAÇÃO DE UM ÁTOMO SEMELHANÇA ATÔMICA ISÓTOPOS: mesmo número de prótons. ISÓBAROS: mesmo número de massa. ISÓTONOS: mesmo número de nêutrons ISOELETRONICOS: mesmo número de elétrons. ÍONS: são átomos que ganharam ou perderam elétrons ELÉTROSFERA NÍVEIS SUBNÍVEIS ORBITAIS ELÉTRONS DISTRIBUIÇÃO ELETRÔNICA NÚMEROS QUÂNTICOS ● NÚMERO QUÂNTICO PRINCIPAL indica o nível que o elétron se encontra ● NÚMERO QUÂNTICO SECUNDÁRIO indica o subnível que o elétron se encontra ● NÚMERO QUÂNTICO MAGNÉTICO indica o orbital em que o elétron se encontra ● NÚMERO QUÂNTICO SPIN indica a rotação do elétron NÚMEROS QUÂNTICOS
Download