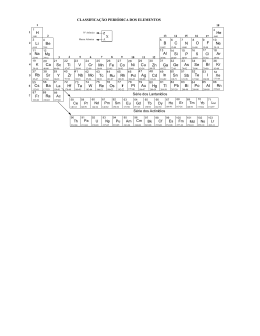
SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA UNIDADE: ___________ DATA: 05 / 12 / 2011 III ETAPA – AVALIAÇÃO ESPECIAL DE QUÍMICA – 2.º ANO/EM ALUNO(A): PROFESSOR(A): N.º: VALOR: 6,0 MÉDIA: 3,6 RESULTADO: TURMA: % (UFMG) Enunciado comum às questões 01 e 02. Estes gráficos apresentam os potenciais de redução do zinco e do cobre, medidos em relação ao eletrodo padrão de hidrogênio, em função das concentrações dos íons metálicos presentes nas soluções: QUESTÃO 01 Uma pilha eletroquímica foi montada com placas de cobre e zinco e soluções aquosas dos respectivos sulfatos. (A) Considerando as informações contidas nos gráficos, escreva a equação balanceada da reação espontânea dessa pilha. 1 B) Neste desenho, estão representados a pilha e o fluxo de elétrons – da direita para a esquerda – no fio metálico: Considerando as informações contidas neste desenho, identifique os metais e soluções constituintes da pilha, indicados com as letras A, B, C e D. 1 QUESTÃO 02 A) Utilizando dados dos gráficos, calcule a força eletromotriz medida nessa pilha, caso as duas soluções tenham concentração igual a 0,5 mol/ L. (Deixe seus cálculos registrados, explicitando, assim, seu raciocínio.) 1 B) Uma segunda pilha foi montada, usando uma solução de CuSO4 (aq), de concentração mais alta que 0,5 mol/L, e uma solução de ZnSO4 (aq), de concentração mais baixa que 0,5 mol/L. Indique se a força eletromotriz dessa nova pilha é menor, igual ou maior que aquela calculada anteriormente. (UFMG) Enunciado comum às questões 03 e 04. Uma das formas de se avaliar a poluição proveniente da queima de combustíveis fósseis é a determinação da quantidade de SO2 na atmosfera. QUESTÃO 03 A) Um dos métodos analíticos para se quantificar o dióxido de enxofre gasoso, SO2 (g), consiste em transformá-lo em ácido sulfúrico, H2SO4 (aq), utilizando-se água oxigenada, H2O2 (aq). Escreva a equação balanceada dessa reação. 1 B) A quantidade de ácido sulfúrico formado pode ser determinada pela reação de neutralização com uma solução de hidróxido de sódio, NaOH (aq), de concentração conhecida. Escreva a equação balanceada da reação completa do ácido com a base. 2 QUESTÃO 04 O dióxido de enxofre contido em uma amostra de 1m3 de ar contaminado foi transformado em ácido sulfúrico. O ácido resultante foi, então, neutralizado com 20 mL de NaOH 1mol/L. Calcule a massa de dióxido de enxofre contido na amostra. (Deixe seus cálculos registrados, explicitando, assim, seu raciocínio.) 1 QUESTÃO 05 (UFMG-ADAPTADA) O composto clorato de potássio, quando aquecido, decompõe-se, produzindo cloreto de potássio e oxigênio molecular. Para estudar a cinética de decomposição desse composto, um estudante preparou duas amostras: Amostra I - Contém somente KClO3; Amostra II - Contém uma mistura de KClO3 com um catalisador, MnO2. Cada uma dessas amostras foi colocada em um cadinho de cerâmica e, em seguida, ao mesmo tempo, os dois cadinhos foram aquecidos. Neste gráfico, estão indicadas as variações de massa observadas durante o aquecimento das duas amostras: 1 Indique a curva que representa a variação da massa da Amostra I. Justifique sua resposta. 3 QUESTÃO 06 (UFMG-ADAPTADA) Em um experimento, utilizando-se um frasco aberto, que contém 3,27 g de zinco metálico em pó, são acrescentados, com agitação, 100 mL de uma solução de ácido clorídrico aquoso, HCl (aq), na concentração de 1,10 mol/L. A) Escreva a equação balanceada que representa a reação de ácido clorídrico com zinco metálico. 1 B) Nesse experimento, reagentes e produtos atingem o estado de equilíbrio? Justifique. CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS 1 H 1,008 3 Li 6,9 11 Na 23,0 19 K 39,1 37 Rb 85,5 55 Cs 132,9 87 Fr (223) 4 Be 9,0 12 Mg 24,3 20 Ca 40,1 38 Sr 87,6 56 Ba 137,3 88 Ra (226) Lantanídio s Actinídios Nº Atômico Elemento Massa Atômica 21 Sc 45,0 39 Y 88,9 57/71 89/103 57 La 138,9 89 Ac (227) 22 Ti 47,9 40 Zr 91,2 72 Hf 178,5 104 Ku (261) 58 Ce 140,1 90 Th 232,0 23 V 50,9 41 Nb 92,9 73 Ta 180,9 105 Ha (260) 59 Pr 140,9 91 Pa (231) 24 Cr 52,0 42 Mo 95,9 74 W 183,8 60 Nd 144,2 92 U 238,0 25 Mn 54,9 43 Tc (99) 75 Re 186,2 61 Pm (147) 93 Np (237) N E M 26 Fe 55,8 44 Ru 101,1 76 Os 190,2 62 Sm 150,4 94 Pu (242) 27 Co 58,9 45 Rh 102,9 77 Ir 192,2 28 Ni 58,7 46 Pd 106,4 78 Pt 195,1 29 Cu 63,5 47 Ag 107,9 79 Au 197,0 30 Zn 65,4 48 Cd 112,4 80 Hg 200,6 5 B 10,8 13 Al 27,0 31 Ga 69,7 49 In 114,8 81 Tl 204,4 63 Eu 152,0 95 Am (243) 64 Gd 157,3 96 Cm (247) 65 Tb 158,9 97 Bk (249) 66 Dy 162,5 98 Cf (251) 67 Ho 164,9 99 Es (254) DRB/gmf 4 6 C 12,0 14 Si 28,1 32 Ge 72,6 50 Sn 118,7 82 Pb 207,2 7 N 14,0 15 P 31,0 33 As 74,9 51 Sb 121,8 83 Bi 209,0 8 O 16,0 16 S 32,1 34 Se 79,0 52 Te 127,6 84 Po (210) 9 F 19,0 17 Cl 35,5 35 Br 79,9 53 I 126,9 85 At (210) 68 Er 167,3 100 Fm (253) 69 Tm 168,9 101 Md (256) 70 Yb 173,0 102 No (253) 71 Lu 175,0 103 Lr (257) 2 He 4,0 10 Ne 20,2 18 Ar 39,9 36 Kr 83,8 54 Xe 131,3 86 Rn (222)
Download




![Pilhas Alcalinas 2[1]](http://s1.livrozilla.com/store/data/000255829_1-8ff48320fd53e545e4e4b0f7acd7661e-260x520.png)