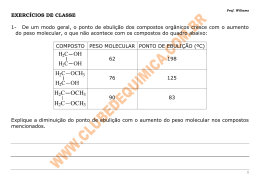
Prof. Willame EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR PONTO DE EBULIÇÃO (ºC) H2C OH 62 198 76 125 90 83 H2C OH H2C OCH3 H2C OH H2C OCH3 H2C OCH3 Explique a diminuição do ponto de ebulição com o aumento do peso molecular nos compostos mencionados. 1 Prof. Willame 2- Observe a fórmula estrutural de algumas vitaminas abaixo: O O OH H3C CH3 CH3 CH3 OH OH HO OH I O CH3 CH3 II CH3 CH3 CH3 CH3 III CH3 O CH3 O HO N CH3 COOH H OH IV Uma das propriedades que determina a maior ou menor concentração de uma vitamina na urina é sua solubilidade em água. Qual dessas vitaminas é mais facilmente eliminada na urina? Justifique. 2 Prof. Willame 3- Em um laboratório, três frascos com líquidos incolores estão sem os devidos rótulos. Ao lado deles, estão os três rótulos com as seguintes identificações: ácido etanóico, pentano e 1 – butanol. Para poder rotular corretamente os frascos, determinam-se, para esses líquidos, o ponto de ebulição (P. E.) sob 1 atm e a solubilidade em água (S) a 25 º C. Líquido P. E. / ºC S/ (g/100 mL) X 36 0,035 Y 117 7,3 Z 118 infinita Com base nessas propriedades, conclui-se que os líquidos X, Y e Z são, respectivamente: a)1- butanol,ácido etanóico b) 1- butanol, pentano e c) ácido etanóico, pentano e d) pentano, 1- butanol e e)pentano, ácido etanóico e pentano. ácido etanóico. 1- butanol. ácido etanóico. e 1- butanol. 3 Prof. Willame 4- Com base nesta tabela: Alcanos Ponto de ebulição (ºC) CH3 CH3 C CH3 9,3 CH3 CH3 CH CH2 CH3 CH3 CH3 C C C CH3 H2 H2 H2 28,0 36,2 Conclui-se que os pontos de ebulição dos alcanos apresentados aumentam com: a)O b) A c) O d) A e)O aumento de suas massas moleculares. diminuição do número de ramificações. aumento do número de agrupamentos metila. diminuição da cadeia principal. aumento das interações por pontes de hidrogênio. 4 Prof. Willame 5- Sobre as ligações intermoleculares podemos afirmar: a) As ligações dipolo-dipolo são estabelecidas entre moléculas apolares. b) As forças de Van der Waals são ligações mais fortes do que as ligações covalentes c) As pontes de hidrogênio ocorrem quando se tem átomo de hidrogênio ligado a átomos pequenos e fortemente eletronegativos (F, O e N). d) As pontes de hidrogênio são ligações mais fracas do que as ligações dipolo-dipolo. e) As ligações intermoleculares são responsáveis pelas propriedades químicas das substâncias 5 Prof. Willame 6- Observe tabela a seguir. Substância Tipo de Força Intermolecular Ponto de Ebulição (º C) Butano I 0,6 II 8,0 III 97 (Hidrocarboneto) Metóxi – etano (Éter) Propanol (Álcool) Com base no dados da tabela, assinale a opção em que os tipos de interação entre moléculas semelhantes substituem I, II e III, respectivamente: a) b) c) d) e) dipolo induzido – pontes de hidrogênio – dipolo permanente dipolo permanente - dipolo induzido - pontes de hidrogênio pontes de hidrogênio - dipolo induzido - dipolo permanente dipolo induzido - dipolo permanente - pontes de hidrogênio pontes de hidrogênio - dipolo permanente - dipolo induzido 6
Download