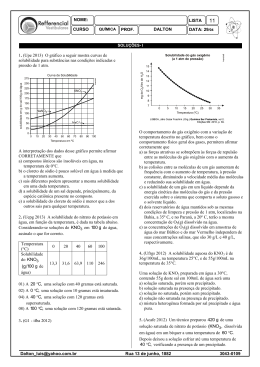
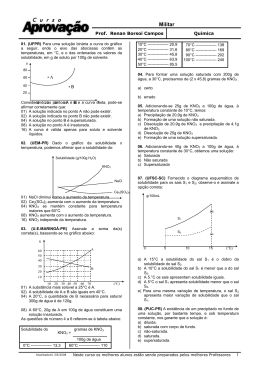
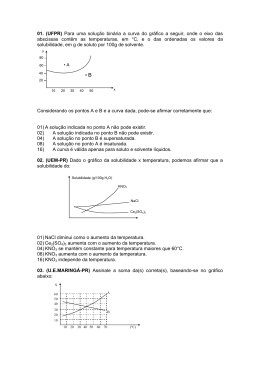
2o EM QUÍMICA 2º TRIMESTRE 08 07 15 LISTA DE REVISÃO DE FÍSICO QUÍMICA 1. (Fuvest 1989) A curva de solubilidade do KNO3 em função da temperatura é dada a seguir. Se a 20°C misturarmos 50g de KNO3 com 100g de água, quando for atingido o equilíbrio teremos a) um sistema homogêneo. b) um sistema heterogêneo. c) apenas uma solução insaturada. d) apenas uma solução saturada. e) uma solução supersaturada. 2. (Fuvest 1990) O processo de recristalização, usado na purificação de sólidos, consiste no seguinte: 10.) Dissolve-se o sólido em água quente, até a saturação. 20.) Resfria-se a solução até que o sólido se cristalize. Os gráficos a seguir mostram a variação, com a temperatura, da solubilidade de alguns compostos em água. O método de purificação descrito acima é mais eficiente e menos eficiente, respectivamente, para: a) NaCℓ e KNO3 b) KBr e NaCℓ c) KNO3 e KBr d) NaCℓ e KBr e) KNO3 e NaCℓ Teste 1º tri 3. (Unicamp 1991) Uma solução saturada de nitrato de potássio (KNO3) constituída, além do sal, por 100 g de água, está à temperatura de 70 °C. Essa solução é resfriada a 40 °C, ocorrendo precipitação de parte do sal dissolvido. Calcule: a) a massa do sal que precipitou. b) a massa do sal que permaneceu em solução. A seguir, o gráfico da solubilidade do nitrato de potássio em função da temperatura. 4. (Cesgranrio 1991) A curva de solubilidade de um sal hipotético é: A quantidade de água necessária para dissolver 30 gramas do sal a 35°C será, em gramas: a) 45 b) 60 c) 75 d) 90 e) 105 5. (Fuvest 1993) A recristalização consiste em dissolver uma substância a uma dada temperatura, no menor volume de solvente possível e a seguir resfriar a solução, obtendo-se cristais da substância. Duas amostras de ácido benzoico, de 25,0 g cada, foram recristalizadas em água segundo esse procedimento, nas condições apresentadas na figura 1: a) Calcule a quantidade de água necessária para a dissolução de cada amostra. b) Qual das amostras permitiu obter maior quantidade de cristais da substância? Explique. Dados: curva de solubilidade do ácido benzoico em água (massa em gramas de ácido benzoico que se dissolve em 100g de água, em cada temperatura), ver figura 2. Teste do 1º tri 6. (Fei 1995) Tem-se 500g de uma solução aquosa de sacarose (C12H22O11), saturada a 50°C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30°C? Dados: Coeficiente de solubilidade (Cs) da sacarose em água: Cs à 30°C=220g/100g de água Cs à 50°C=260g/100g de água a) 40,0 g b) 28,8 g c) 84,25 g d) 55,5 g e) 62,5 g 7. (Fuvest 1996) 160 gramas de uma solução aquosa saturada de sacarose a 30°C são resfriados a 0°C. Quanto do açúcar cristaliza? Temperatura °C Solubilidade da sacarose g/100 g de H2O 0 180 30 220 a) 20 g. b) 40 g. c) 50 g. d) 64 g. e) 90 g. 8. (Fatec 1997) O processo Solvay de obtenção do Na2CO3, matéria-prima importante na fabricação do vidro, envolve os reagentes CO2, NH3 e solução saturada de NaCℓ. Na solução final encontram-se os íons NH4 (aq), Na+(aq), Cℓ-(aq) e HCO3 (aq) Analisando, no gráfico apresentado, as curvas de solubilidade em função da temperatura, é correto afirmar que, na temperatura de 20°C, o sólido que deverá precipitar primeiro é o a) NH4Cℓ b) NaHCO3 c) NH4HCO3 d) NaCℓ e) Na2CO3 Teste do 1º tri 9. (Fuvest 1990) A seguir é apresentada a concentração, em mg/kg, de alguns íons na água do mar: Dentre esses íons, os que estão em menor e maior concentração molar são, respectivamente: a) Cℓ- e Mg2+. b) (SO4)2- e Na+. c) Mg2+ e Na+. d) Mg2+ e Cℓ-. e) (SO4)2- e Cℓ-. Massas atômicas: O = 16; Na = 23; Mg = 24; S = 32; Cℓ = 35,5 10. (Fuvest 1991) Quatro tubos contêm 20 mL (mililitros) de água cada um. Coloca-se nesses tubos dicromato de potássio (K2Cr2O7) nas seguintes quantidades: A solubilidade do sal, a 20°C, é igual a 12,5 g por 100 mL de água. Após agitação, em quais dos tubos coexistem, nessa temperatura, solução saturada e fase sólida? a) Em nenhum. b) Apenas em D. c) Apenas em C e D. d) Apenas em B, C e D. e) Em todos. 11. (Puccamp 1994) No preparo de solução alvejante de tinturaria, 521,5g de hipoclorito de sódio são dissolvidos em água suficiente para 10,0 litros de solução. A concentração, em mol/L, da solução obtida é (Dado: Massa molar do NaCℓO = 74,5g/mol) a) 7,0 b) 3,5 c) 0,70 d) 0,35 e) 0,22 12. (Fei 1995) Que volume de água destilada devemos adicionar a 150,0mL de uma solução a 7,00% de um shampoo para automóvel a fim de torná-la a 3,00%? a) 50,0 mL b) 100,0 mL c) 200,0 mL d) 450,0 mL e) 750,0 mL 13. (Ufpe 1995) Uma solução de um sulfato contém uma concentração 1,0 mol/L de íons sulfato (SO4-2). Podemos afirmar que esta solução pode conter: a) íons alumínio (Aℓ3+) numa concentração 2/3 moles/L; b) íons férrico (Fe3+) numa concentração 1,0 mol/L; c) íons cloreto (Cℓ-) numa concentração 2,0 moles/L; d) íons nitrato (NO3-) numa concentração 2/3 moles/L, e) íons bário (Ba3+) numa concentração 4/3 moles/L. Teste do 1º tri 14. (Unitau 1995) Para matar baratas, precisamos fazer uma solução aquosa a 30% de ácido bórico (d=1,30g/cm3), com concentração molar de (Dados: H=1, B=10,8, O=16) a) 6,5 M. b) 6,0 M. c) 5,5 M. d) 5,0 M. e) 4,5 M. 15. (Unaerp 1996) O propileno glicol, C3H8O2 é um líquido utilizado como umectante de doces, produtos de cacau e carne. Para se preparar 100ml de solução 3 Molar de propileno glicol, a massa a ser pesada deverá ser de: (Dados: C = 12 ; O = 16 ; H = 1) a) 228 g. b) 10,8 g. c) 108 g. d) 22,8 g. e) 2,28 g. 16. (Mackenzie 1996) Preparou-se uma solução 0,2mol/litro, dissolvendo-se 16,56g de X (CℓO3)2 em água suficiente para que fossem obtidos 400ml de solução. O cátion X é o: Dadas as massas molares (g/mol): Be = 9; Mg = 24; Ca = 40; Sr = 88; Ba = 137; Cℓ = 35,5 ; O = 16 a) Be. b) Mg. c) Ca. d) Sr. e) Ba. 17. (Mackenzie 1996) A concentração em g/L, da solução obtida ao se dissolverem 4 g de cloreto de sódio em 50 cm3 de água é: a) 200 g/L b) 20 g/L c) 0,08 g/L d) 12,5 g/L e) 80 g/L 18. (Uel 1996) Uma solução aquosa de hidróxido de sódio tem densidade igual a 1,25g/mL e 40% em massa de soluto. A massa, em gramas, de 100 mililitros de solução é a) 4,00 b) 40,0 c) 125 d) 250 e) 375 19. (Fatec 1997) Fenol, C6H5OH, conhecido como ácido fênico é usado como desinfetante e na manufatura de plásticos. Dissolvendo-se 0,752g desse composto em água suficiente para 500ml, obtém-se solução cuja concentração expressa em mol/L é: Massas molares: H=1g/mol, C=12g/mol, O=16g/mol a) 0,008 b) 1,504 c) 0,016 d) 1,6 e) 3,2 Teste do 1º tri Gabarito: Resposta da questão 1: [B] Resposta da questão 2: [E] Resposta da questão 3: a) m = 80 g b) m = 60 g Resposta da questão 4: [B] Resposta da questão 5: a) Amostra 1 500 g de H2O Amostra 2 1087 g de H2O (cálculo aproximado) b) Amostra 1: a 20°C o ácido benzoico é menos solúvel. Resposta da questão 6: [D] Resposta da questão 7: [A] Resposta da questão 8: [B] Resposta da questão 9: [E] Resposta da questão 10: [D] Resposta da questão 11: [C] Resposta da questão 12: [C] Resposta da questão 13: [A] Resposta da questão 14: [A] Resposta da questão 15: [D] Resposta da questão 16: [C] Resposta da questão 17: [E] Resposta da questão 18: [C] Resposta da questão 19: [C] Teste do 1º tri
Download