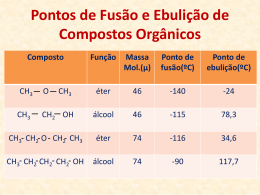
TURMA EMESCAM - QUÍMICA ORGÂNICA Prof. Sandro Lyra AULA 01 – PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS Resumo Teórico ¾ As propriedades físicas mais usadas como comparação entre moléculas orgânicas são: 1ª Ponto de fusão e ponto de ebulição. 2ª Solubilidade em água e em outros solventes. Não é muito complicado comparar essas propriedades entres moléculas orgânicas. Porém, existem algumas particularidades que devem ser abordadas e que se não estivermos atentos podem nos induzir à erros. Vamos abordar primeiro os fatores que alteram o ponto de fusão e o ponto de ebulição. 1ª Ponto de fusão e ponto de ebulição. 1.1. O ponto de fusão e o ponto de ebulição dependem sobretudo de dois fatores: a) Massa Molecular A ideia é que quanto maior a massa molecular maior será o ponto de fusão e o ponto de ebulição. Isso ocorre, entre outras razões, pelo fato de que quanto maior as moléculas mais interações intermoleculares ocorrem entre elas. b) Forças intermoleculares A ideia é que quanto mais forte o tipo de interação intermolecular maior será o ponto de ebulição. Isso ocorre porque interações mais fortes (ligações de hidrogênio > dipolo permanente > dipolo induzido) consomem mais energia para serem rompidas, o que acarreta um aumento no ponto de ebulição. ATENÇÃO! Na hora de comparar o ponto de ebulição entre moléculas orgânicas os dois fatores citados (A e B) devem ser avaliados simultaneamente. Como isso nem sempre é fácil, seguem abaixo algumas dicas para facilitar sua análise. Dica 01: quando comparamos moléculas de mesma função, o fator massa molecular (ou tamanho da cadeia carbônica) é o fator determinante. Ex.1) CH3 — CH2 — OH CH3 — CH2 — CH2 — OH Ex.2) Dica 01: quando comparamos moléculas com funções diferentes o fator determinante será o tipo de interação intermolecular. Fique atento para a massa molecular das moléculas, que deve ser muito semelhante ou igual. Ex.1) CH3 — CH2 — OH CH3 — O — CH3 Ex.2) 1 ¾ Agora vamos avaliar algumas situações especiais e algumas situações muito comuns em vestibulares. 1º caso: Isômeros de funções. 1.1. 1.2. 2º caso: Isômeros de cadeia (normal x ramificada). 2.1. 3º caso: Isômeros de posição. 3.1. 3.2. 3.3. 2 4º caso: Isômeros Geométricos. 4.1. Em geral temos: 4.2. Porém pode ocorrer o contrário: 5º caso: Isômeros Ópticos. 6º caso: Aminas. 6.1. CH3 — CH2 — CH2 — NH2 CH3 — CH2 — NH — CH3 ¾ Após esse resumo teórico, vamos encarar algumas situações desafio. 1. Coloque, em cada caso, as moléculas em ordem decrescente de ponto de ebulição: a) R: b) R: 3 c) R: d) R: e) R: f) R: 4 g) R: h) R: EXERCÍCIOS COMPLEMENTARES 1. Comparando-se o ponto de ebulição de dois álcoois (I) 1,2-etanodiol e (II) 1-propanol, podemos afirmar que: a) O composto (I) deveria ser muito polar; no entanto, a associação intramolecular impede que seu PE seja muito alto. b) A posição do grupo funcional terminal em (II) é responsável pelo seu alto PE. c) O álcool, contendo dois grupos funcionais, é mais polar e, portanto, apresenta PE mais alto. d) A diferença de massas moleculares entre os compostos é responsável pela diferença entre seus PE. e) O álcool, contendo dois grupos funcionais, é menos polar e, portanto, apresenta PE mais alto. 2. a) b) c) d) e) Dentre as opções abaixo, o composto de ponto de ebulição mais baixo é: CH3—CO —CH3 CH3—O—CH2—CH3 CH3—CH2—CH2—OH CH3—CH2—CH3 CH3—CH2—OH 3. À temperatura ambiente, propano, butano, pentano, hexano são respectivamente: a) Líquido, Líquido, gás, gás. c) Gás, Líquido, Líquido, gás. e) Outra ordem. b) Gás, gás, Líquido, Líquido. d) Sólido, Líquido, Líquido, gás. 4. Um aluno determinou experimentalmente o peso molecular do ácido acético vapor, achando um valor próximo de 120. Sendo o peso molecular do ácido acético igual a 60, conclui-se que: a) O aluno errou na determinação. b) O aluno determinou o peso molecular de outra substância. c) Está certa a determinação pois, no estado de vapor, temos um equilíbrio dinâmico entre ácido acético e formiato de metila. d) Está certa a determinação, admitindo-se a dimerização do ácido acético no estado de vapor devido às interações de hidrogênio. e) n.d.a. 5. A ordem decrescente do ponto de ebulição do composto abaixo está melhor representada pela opção: CH3—C(CH3)2—C(CH3)2CH3 CH3—(CH2)6CH3 CH3(CH2)6COOH CH3(CH2)6CH2OH (I) a) III, II, I, IV. b) I, II, IV, III. (II) c) III, IV, I, II. d) IV, III, II, I. (III) 5 (IV) e) III, IV, II, I. 6. Dados os compostos orgânicos: (I) n-octano; (II) tetrametil-butano; (III) 3,4dimetil-hexano; (IV)3-metil-heptano; (V)2,2,4-trimetil-pentano. A sequência que apresenta as substâncias na ordem crescente de pontos de ebulição é: a) II-V-III-IV-I. c) I-IV-III-V-II. e) V-IV-III-II-I. b) I-II-III-IV-V. d) II-V-IV-III-I. 7. a) b) c) d) e) Das sequências abaixo, qual delas representa a ordem das temperaturas de ebulição dos haletos de etila? C2H5F > C2H5Cl > C2H5Br > C2H5I. C2H5F < C2H5Cl < C2H5Br > C2H5I. C2H5F < C2H5Cl > C2H5Br > C2H5I. C2H5F < C2H5Cl < C2H5Br < C2H5I. n.d.a 8. Sejam dadas as seguintes substâncias: a) b) c) d) e) Em relação a essas substâncias, todas as afirmativas estão corretas, exceto: I é usada como combustível. II é insolúvel em água. III é utilizada como inseticida. IV é usada como gás de maçarico. V é usada como solvete. 9. (FCMMG) A ordem decrescente do ponto de ebulição dos compostos a seguir está melhor representada pela opção: a) III, II, II, IV. b) I, II, IV,III. 10. a) b) c) d) e) c) III, IV, I,II. d) IV, III, II, I. e) III, IV, IV, I. (UFMG) Isopentano tem ponto de ebulição mais baixo do que o de n-pentano, porque: a molécula de isopentano tem mais ramificações por onde escoa o calor. a molécula de n-pentano forma mais ligações de hidrogênio do que a de isopentano. a superfície de contato entre moléculas de isopentano é maior. a molécula de n-pentano tem maior massa molar. as forças de van der Waals são mais intensas entre moléculas de n-pentano. 11. (UFMG-94) Em relação ao aldeído acético e ao ácido acético, todas as afirmativas estão corretas, exceto: a) As moléculas do ácido acético possuem um átomo de oxigênio a mais do que as do aldeído acético. b) As molecular do aldeído acético formam ligações intermoleculares mais intensas do que as do ácido acético. c) O aldeído acético é um redutor mais forte do que o ácido acético. d) O pH de uma solução de ácido acético é menor do que o de uma solução de aldeído acético. e) O ponto de ebulição do ácido acético é maior do que o do aldeído acético. 12. (UFMG-94) Cinco gotas de acetona e cinco gotas de etanol foram colocadas separadamente sobre uma placa de vidro. A acetona evaporou-se totalmente em primeiro lugar. Todas as alternativas contêm explicações corretas para esse fenômeno, EXCETO: a) A acetona é mais volátil do que o etanol. b) A interação intermolecular na acetona é menor do que no o etanol. c) A massa molar da acetona é maior do que a do etanol. d) A polaridade das moléculas da acetona é menor do que a das moléculas do etanol. e) A pressão de vapor da acetona é maior do que a do etanol. 6 13. (UFSC) Examine as estruturas moleculares do álcool benzílico e do etilbenzeno abaixo representadas. Assinale a(s) proposição (ões) correta(s). 01. O ponto de ebulição do etilbenzeno deve ser menor do que o do álcool benzílico. 02. O álcool benzílico deve ser menos solúvel em água do que o etilbenzeno, ambos à mesma temperatura. 04. O álcool benzílico deve ter uma pressão de vapor maior que aquela do etilvenzeno, ambos sob as mesmas condições. 08. As interações intermoleculares existentes no álcool benzílico são do tipo dipolo permanente— dipolo permanente. 16. As interações intermoleculares existentes no etilbenzeno são, basicamente, do tipo dipolo induzido—dipolo induzido. 7
Download