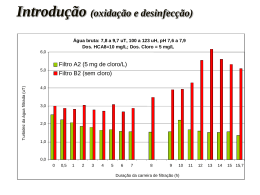
QUÍMICA AMBIENTAL Química das Águas - parte 2 Aulas S05 e S06 : - Parâmetros de qualidade das águas - Purificação de águas poluídas (Tratamento de água) Prof. Rafael Sousa Departamento de Química – UFJF 2º período de 2013 Recapitulando ... Química Ambiental - contexto multidisciplinar - Relação entre poluição e desenvolvimento sócio-econômico - Química analítica é uma ferramenta importante para a monitoração ambiental Técnicas instrumentais devem ser preferidas Características das águas naturais (que não são puras) - A água é um bem natural de alto valor agregado - Vários exemplos de substâncias tóxicas na água - Os diferentes processos químicos aquáticos podem ser influenciados pela poluição ambiental INDICADORES DE QUALIDADE DAS ÁGUAS CONTEXTO: O aporte de substâncias nos mananciais Origina-se de várias FONTES: - Efluentes domésticos e industriais - Escoamentos superficial urbano e agrícola DEPENDE do tipo de uso e ocupação do solo Cada uma dessas FONTES possui características próprias quanto aos poluentes que transportam, como: - Contaminantes orgânicos (que deveriam ser biodegradáveis) - Nutrientes (que podem causar eutrofiação) - Bactérias ... INDICADORES DE QUALIDADE DAS ÁGUAS CONTEXTO DA POLUIÇÃO DAS ÁGUAS: Mesmo separando os poluentes em grupos, a diversidade das indústrias existentes aumenta, ainda mais, a variabilidade dos contaminantes aportados nos corpos de água Torna-se praticamente impossível a determinação sistemática de todos os poluentes que possam estar presentes nas águas superficiais, em tempo relativamente curto... Físicos Existem parâmetros de qualidade de água, levando em conta os poluentes mais representativos Químicos Microbiológicos Bioensaios ecotoxicológicos INDICADORES DE QUALIDADE DAS ÁGUAS Parâmetros de qualidade Indicadores de qualidade das águas Usados para a MONITORAÇÃO e FISCALIZAÇÃO ambiental com base da legislação CONAMA nº 357, de 17 de março de 2005 CETESB: Companhia de Tecnologia de Saneamento Ambiental (Secretaria de Meio Ambiente de SP) - http://www.cetesb.sp.gov.br/ IGAM: Instituto Mineiro de Gestão das Águas - http://www.igam.mg.gov.br/ INDICADORES DE QUALIDADE DAS ÁGUAS Os parâmetros de qualidade PARÂMETROS FÍSICOS Temperatura, condutividade elétrica, sólidos, cor e turbidez Temperatura - Solubilidade de gases como o O2 O aumento da T diminui - Favorece processos aeróbicos mau cheiro (produtos de degradação) PARÂMETROS FÍSICOS DE QUALIDADE Temperatura, condutividade elétrica, sólidos, cor e turbidez Condutividade elétrica É ocasianada pelas substâncias dissolvidas que se dissociam em cátions e ânions e cuja dissolução também é função da temperatura Muitos sais encontrados nas águas são de origem antropogênica - Descargas industriais - Consumo de sal nas residências - Excreções da população e animais MONITORAÇÃO = IDENTIFICAR MODIFICAÇÕES NA COMPOSIÇÃO PARÂMETROS FÍSICOS DE QUALIDADE Temperatura, condutividade elétrica, sólidos, cor e turbidez Sólidos Correspondem a partículas diversas, sedimentáveis ou não e que podem ser separadas por filtração sólidos Impurezas na água contribuem para o aumento na quantidade de A MEDIÇÃO DOS SÓLIDOS NÃO DISSOLVIDOS é o “peso” dos sólidos filtráveis, expresso em mg/L PARÂMETROS FÍSICOS DE QUALIDADE Temperatura, condutividade elétrica, sólidos, cor e turbidez Cor NATURAL: teor de matéria orgânica decomposta e íons de Fe e Mn ALTERADA: ações antropogênicas... Turbidez É uma medida que representa o quanto uma amostra de água interfere na luz que passa por ela Águas turvas desfavorecem a fotossíntese de vegetações submersas (menos vegetação menos peixes) INDICADORES DE QUALIDADE DAS ÁGUAS PARÂMETROS QUÍMICOS Alcalinidade, dureza, pH Oxigênio dissolvido, demanda bioquímica de oxigênio (DBO), demanda química de oxigênio (DQO) Série de nitrogênio (orgânico, amoniacal, nitrato e nitrito) Fósforo total Surfactantes Óleos e graxas Cianetos Fenóis e demais contaminantes orgânicos Ânions (cloretos, sulfetos) Íons metálicos (ferro, potássio, sódio, magnésio, manganês, alumínio, zinco, bário, cádmio, níquel, chumbo, cobre, cromo (III), cromo (VI), selênio, mercúrio), arsênio e boro PARÂMETROS QUÍMICOS Alcalinidade, dureza, pH - Relacionados com as espécies CO2, CO3 2-, Ca 2+, Mg (correlacionadas) Águas mais alcalinas geralmente “dureza moderada” a “muito dura” pouca quantidade de íons H+ - Dureza pode ser expressa de várias formas ( dureza de cálcio, dureza de magnésio, dureza total ([Ca 2+] 2+ e H+ + [Mg2+]) - IMPORTÂNCIA desses parâmetros Seres vivos necessitam de água em pH próximo à neutralidade Tubulações de água (domésticas ou industriais) podem ser entupidas (águas duras) ou ter elementos metálicos lixiviados... Níveis fora dos padrões Água com sabor desagradável e pode ter efeitos laxativos INDICADORES DE QUALIDADE DAS ÁGUAS PARÂMETROS QUÍMICOS Alcalinidade, dureza, pH Ex de classificação da dureza total da água, expressa em quantidade de CaCO3 Dureza mg/L de CaCO3 Classificação da água <15 muito branda de 15 a 50 branda de 50 a 100 moderadamente branda de 100 a 200 dura >200 muito dura Oxigênio dissolvido, demanda bioquímica demanda química de oxigênio (DQO) de oxigênio (DBO), - Expressam o teor de oxigênio dissolvido e indicam os tipos possíveis de poluentes - Demanda bioquímica de oxigênio É a quantidade de oxigênio necessária para oxidar a matéria orgânica por meio de processos bioquímicos, que podem ser monitorados no laboratório” - Demanda química de oxigênio “É a quantidade de oxigênio necessária para oxidar a matéria orgânica através de um agente químico” Útil para detectar substâncias resistentes à degradação biológica => Os valores obtidos são geralmente maiores do que os da DBO e podem ser conseguidos em menos tempo - Série de nitrogênio (orgânico, amoniacal, nitrato e nitrito) - Fósforo total: medida pouco seletiva (métodos espectroscópicos) Teores relativamente altos de espécies desta classe indicam poluição por efluentes industriais e/ou domésticos NH3 é geralmente encontrada em baixas concentrações APESAR DA TOXICIDADE, não é persistente Em concentrações baixas não causa danos aos seres humanos mas pode ocasionar sufocamento de peixes Surfactantes São os constituintes dos detergentes i) aniônicos (R-SO3-)Na+ i i) catiônicos (RMe3-N+)Cl- i ii) não iônicos Diminuem a tensão superficial da água geram espuma e deixam a “sujeira” em suspensão inconvenientes estético e para a biota Óleos e graxas (parâmetro OG) - Substâncias orgânicas pouco encontradas em águas superficiais - MAS por serem pouco solúveis em água, dificultam tanto o tratamento de efluentes (processos biológicos) como o da água de abastaecimento Fenóis e demais contaminantes orgânicos Ocorrem em consequência de despejos industriais Além de afetarem o sabor dos peixes e da água, podem causar: - lesões na pele - indisposições físicas de diversos tipos Toxicidade depende da espécie Ânions (cloretos, sulfetos) - Constituem sais presentes na água Aumento na concentração poluição doméstica (Cl-) e industrial Íons metálicos (Al, Sb, Ba, Be, Cd, Pb, Co, Cu, Cr, Fe, Li, Mn, Hg, Ni, Ag, Se, U, V, Zn), arsênio e boro - Fontes: despejo de efluentes e lixiviação de fertilizantes - Toxidade: depende da espécie (especiação química) INDICADORES DE QUALIDADE DAS ÁGUAS PARÂMETROS MICROBIOLÓGICOS Coliformes fecais e totais - Bactérias encontradas principalmente nos intestinos de animais de “sangue quente” não representam, por si só, perigo à saúde - Dentre as cepas: Escherichia coli é de origem fecal Estreptococos totais Escherichia coli - Bactérias patogênicas - Classificadas em grupos (sinais clínicos e sintomas) BIOENSAIOS ECOTOXICOLÓGICOS (ENSAIOS DE TOXICIDADE) Determinação do potencial tóxico de um agente químico ou de uma mistura Efeito poluentes: resposta de organismos vivos Método O crustácio Ceriodaphnia dubia é colocado em contato com a água contendo as substâncias em avalição Os efeitos observados definem o grau da toxicidade: - Aguda (0 a 96 horas) observação principal é o efeito morte - Crônica (1/10 do ciclo vital até a totalidade da vida do organismo) resposta causa mudanças comportamentais, alterações fisiológicas, reprodutivas, etc INDICADORES DE QUALIDADE DAS ÁGUAS Para facilitar a interpretação das informações sobre a qualidade da água de forma abrangente e útil, , a CETEB e o IGAM, adaptaram e desenvolveram o Índice de Qualidade das Águas - IQA O IQA incorpora nove parâmetros considerados relevantes para a avaliação da qualidade das águas: - Oxigênio dissolvido - Coliformes fecais - pH - Demanda bioquímica de oxigênio - Nitratos - Fosfatos - Variação na temperatura - Turbidez - Resíduos totais INDICADORES DE QUALIDADE DAS ÁGUAS Cálculo do IQA e aplicação 9 IQA = qi wi i=1 Produto ponderado de parâmetros de qualidade Variando de 0 a 100 qi qualidade do parâmetro i obtido através da curva média específica de qualidade gráfico) usado como referência (parâmetro wi peso atribuído ao parâmetro função de sua importância na qualidade, em função de uma tabela Utilizado para avaliar águas destinadas ao abastecimento público INDICADORES DE QUALIDADE DAS ÁGUAS Cálculo do IQA – “pesos” dos parâmetros Parâmetro Peso - wi Oxigênio Dissolvido – OD (%OD Sat) 0,17 Coliformes fecais (NMP/100mL) 0,15 pH 0,12 Demanda Bioquímica de Oxigênio – DBO (mg/L) 0,10 Nitratos (mg/L NO3) 0,10 Fosfatos (mg/L PO4) 0,10 Variação na temperatura (0C) 0,10 Turbidez (NTU) 0,08 Resíduos Totais (mg/L) 0,08 INDICADORES DE QUALIDADE DAS ÁGUAS Cálculo do IQA – “qualidade” dos parâmetros Exemplo: INDICADORES DE QUALIDADE DAS ÁGUAS Valores de referência do IQA Nível de Qualidade Excelente Bom Médio Ruim Muito Ruim Faixa 90 < IQA 100 70 < IQA 90 50 < IQA 70 25 < IQA 50 0 < IQA 25 O IQA reflete a interferência por esgotos sanitários e outros materiais orgânicos, nutrientes e sólidos Sendo a poluição das águas um fato “real”, Necessidade de tratamento de águas e efluentes – causa histórica O aumento da população e o desenvolvimento industrial Poluem a água usada no abastecimento geram efluentes domésticos e industriais - Também poluem a água e o solo ... Existem PROCESSOS físicos, químicos e biológicos para tratar ÁGUAS POLUÍDAS Águas usadas para abastecimento Efluentes INTRODUÇÃO A ÁGUA usada para ABASTECIMENTO A água para essa finalidade sempre deve ser tratada ? FONTES potáveis: Processo de desinfecção FONTES não potáveis: Estação de Tratamento de Água (ETA) FONTES de água para abastecimento Águas superficiais (geralmente menos “puras”) Expostas continuamente a vários tipos de poluentes Águas subterrâneas FIGURA: http://www.grupoescolar.com/a/b/FA37F.jpg, acessada 10-06-13 ESTAÇÃO DE TRATAMENTO DA ÁGUA (ETA) PROCESSO REALIZADO EM ETAPAS 1º- Coagulação/floculação 2º- Decantação 3º- Filtração 4º- Desinfecção Estas operações têm como principais objetivos: - A remoção de material particulado, bactérias e algas - Remoção da matéria orgânica dissolvida que confere cor à água -.Remoção ou destruição de organismos patogênicos tais como bactérias e vírus Estas operações podem sofrer variações dependendo da fonte de água e dos padrões de qualidade a serem alcançados A ESTAÇÃO DE TRATAMENTO DA ÁGUA Esquema simplificado de uma ETA * (Linha líquida) A ETA também tem uma estação de tratamento de sólidos (Linha sólida) São tratados os resíduos gerados na Linha líquida (*) http://www.aguasdesantoandre.pt/layout.asp?area=9&subarea=25, acessado dia 05-06-13 1- Captação AS ETAPAS DO TRATAMENTO DA ÁGUA A água que chega à Estação de Tratamento de Água é captada diretamente nos rios (águas superficiais) ou no subsolo (águas subterrâneas) LINHA LÍQUIDA 2- Gradagem São retirados da água os resíduos de maior dimensão como folhas, ramos, embalagens, etc., que ficam retidos em grades por onde a água é forçada a passar PROCESSOS DE CLARIFICAÇÃO 3- Floculação/ coagulação São formados “flocos” com as susbtâncias dispersas e um reagente floculante: os contaminantes co-precipitam com o Al(OH)3, p. ex., na etapa de Decantação melhora os índices de turbidez (partículas > 10-4 mm), cor e sabor (partículas menores que 10-4 mm) AS ETAPAS DO TRATAMENTO DA ÁGUA Floculação/ coagulação São formados “flocos” com as susbtâncias dispersas e um reagente floculante: os contaminantes co-precipitam com o Al(OH)3, p. exx., na etapa de Decantação melhora os índices de turbidez (partículas > 10-4 mm), cor e sabor (partículas menores que 10-4 mm) - Uso de agentes “floculantes”: Al2(SO4)3 , sais de ferro e polímeros orgânicos Necessidade de remoção de Mg2+: Al2 (SO4)3 + NaAlO2 Ex de reação em água levemente alcalina: Al2(SO4)3 14,3 H2O + 3Ca(HCO3)2 2 Al(OH)3 + 3CaSO4 + 6CO2 + 14,3H2O ANÁLISES PRÉVIAS são importantes para ajustar o pH , quando necessário AS ETAPAS DO TRATAMENTO DA ÁGUA Esta etapa é realizada em câmaras (floculadores) onde agitada, facilitando a aglutinação de impurezas água é levemente Água superficial sendo tratada em uma ETA, após a adição de um agente floculante Parte da purificação da água ocorre por meio de um processo de “transferência de fase” AS ETAPAS DO TRATAMENTO DA ÁGUA 4- Decantação É um processo de separação física das partículas em suspensão, clarificando a água e reduzindo em grande porcentagem as impurezas As partículas decantadas, mais “pesadas” que a água, ficam depositadas no fundo do decantador Processo que dura, em média, 3 h 5- Filtração A água passa por filtros de areia e/ou carvão ativado, nos quais ficam retidas as partículas pequenas (não decantadas) e uma infinidade de substâncias solúveis (adsorção no carvão) melhora características como odor e sabor PROCESSOS DE DESINFECÇÃO AS ETAPAS DO TRATAMENTO DA ÁGUA 6- Desinfeção (geralmente cloração ou ozonização ou radiação UV) É a eliminação de microorganismos não retidos nas etapas anteriores Adição de “cloro” (gás ou solução de hipoclorito) Fluoretação: adição de “flúor” (fluorsilicato de sódio ou ácido fluorsilícico) ANÁLISES DE CONTROLE ETAPA FINAL: análises físico-químicas e microbiológicas para atestar a qualidade da água (Portaria número 518 do Ministério da Saúde, de 25 de março de 2004) ARMAZENAGEM DISTRIBUIÇÃO PARA AS RESIDÊNCIAS (podem ocorrer contaminações) AS ETAPAS DO TRATAMENTO DA ÁGUA Ficam resíduos (tanque decantação): tratamento da Linha SÓLIDA Desidratação de Lamas “Sobram” resíduos provenientes dos processos de clarificação: lamas São encaminhadas para a desidratação (estabilização química) e estabilização microbiológica devido à grande quantidade de água - A desidratação (secagem) pode ser feita de várias formas: evaporação em leitos, uso de filtros (tipo prensa), etc - A lama tratada é transportada para um destino final adequado, sendo possível o seu aproveitamento como adubo orgânico: Composição, em % média, de lamas de ETAs após tratamento CONSIDERAÇÕES SOBRE O TRATAMENTO DA ÁGUA (DESINFECÇÃO) A desinfecção ocorre para assegurar que a água esteja livre de microorganismos patogênicos Os processos utilizados tem vantagens e desvantagens ! A cloração é o método de desinfecção mais comumente utilizado na maioria dos países Quantidades suficientes de “cloro” são adicionadas à água visando destruir ou inativar os organismos alvo É um método confiável, de relativo baixo custo, simplicidade operacional e cujo excesso, no tratamento, favorece a biosegurança no armazenamento e transporte da água tratada CONSIDERAÇÕES SOBRE O TRATAMENTO DA ÁGUA: DESINFECÇÃO COM CLORO Reações químicas: O gás cloro reage quase completamente com a água formando o ácido hipocloroso: Cl2 + H2O HOCl + H+ + Cl- Em pH mais alcalinos, o ácido hipocloroso se dissocia, gerando os íons H+ e OCl-: HOCl H+ + OClESPÉCIES BACTERICIDAS DE “CLORO LIVRE” O Cl2 reage também com outras espécies presentes na água, antes de se converter em HOCl ou OCl- “Problema”: o cloro reage com substâncias orgânicas presentes na água produzindo trialometanos (THM): CHX3 (X = cloro, bromo ou uma combinação de ambos) CONSIDERAÇÕES SOBRE O TRATAMENTO DA ÁGUA: DESINFECÇÃO COM CLORO Problemas da desinfecção com cloro O composto de maior preocupação é o CHCl3: clorofórmio Produto da reação do HOCl reage com matéria orgânica Os THM não são removidos da água através do tratamento convencional Deve-se assegurar que a matéria orgânica esteja ausente da água que vai ser submetida à cloração ! O risco de contrair doenças causadas por esses compostos é menor do que o de contrair doenças por organismos patogênicos ! CONSIDERAÇÕES SOBRE O TRATAMENTO DA ÁGUA: DESINFECÇÃO COM CLORO E DIÓXIDO DE CLORO Outro problema da desinfecção com cloro Se a água contém fenol ou um derivado, o cloro substitui facilmente os átomos de hidrogênio do anel para dar lugar a fenóis clorados que além do gosto e odor ofensivos, são tóxicos Troca-se o cloro por dióxido de cloro quando o suprimento de água bruta está contaminado temporariamente com fenóis, sendo usando especialmente nos EUA e Europa ENTRETANTO, propriamente o uso do ClO2 . não é uma cloração Reação de obtenção Obtenção a partir de clorito: ClO2- ClO2 oxidação . + e- (realizada in situ) CONSIDERAÇÕES SOBRE O TRATAMENTO DA ÁGUA: DESINFECÇÃO COM CLORO E DIÓXIDO DE CLORO Desvantagens na utilização de dióxido de cloro Assim como o ozônio, não pode ser estocado (explosivo) sendo gerado in situ “Pequenas” frações de dióxido de cloro são convertidas em íons ClO2e ClO3- cuja presença RESIDUAL na água final pode causar problemas de saúde Vantagens na utilização de dióxido de cloro O dióxido de cloro não é um agente de cloração: geralmente não introduz átomos de cloro nas substâncias com as quais reage Oxida a matéria orgânica formando quantidades muito menores de subprodutos orgânicos tóxicos que quando é usado cloro molecular REFERÊNCIAS CONSULTADAS 1 – BAIRD, C., Química Ambiental, Bookman, 2002, p. 483-524. 2 - http://www.igam.mg.gov.br (Qualidade das Águas Superficiais do Estado de Minas Gerais em 2004: Superficiais na Bacia do Rio Jequitinhonha em 2004. Belo Horizonte: IGAM Monitoramento das Águas, 2004, 116p). 3- Manual de Procedimentos e Técnicas Laboratoriais Voltado para Análises de Águas e Esgotos Sanitário e Industrial. Escola Politécnica da Universidade de São Paulo, 2004. 4- http://www.emite.com.br/orbeco/611_a.html, acessado em 30-05-13. 5- http://www.quimis.com.br/produtos.php?cat=5&sub=2&prod=21, acessado em 30-05-13. 6- Nascentes, C. C.; Costa, L. M. Química Ambiental. UFMG, 2011. 7- http://www.portalsaofrancisco.com.br/alfa/coliformes/coliformes.php, acessado 02-06-13 8– Pita, F. A. G. Armazenamento e tratamento de resíduos. Vol. II – Tratamento de Águas Residuais Domésticas, Universidade de Coimbra, 2002. 9- http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf, acessado 13-11-12.
Download