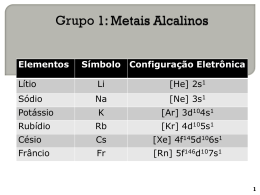
18/01/2014 Universidade Federal dos Vales do Jequitinhonha e Mucuri Instituto de Ciência e Tecnologia Diamantina - MG Metais Alcalinos Profa. Dra. Flaviana Tavares Vieira [email protected] 1 Tópicos I. Elementos do Grupo 1A II. Propriedades dos Metais Alcalinos III. Compostos de Li, Na e K 3 Elementos do Grupo 1A – Metais Alcalinos 4 Por que eles têm esse nome? -Porque reagem muito facilmente com a água e, quando isso ocorre, formam hidróxidos e gás hidrogênio. 2 Li(s) + 2 H2O(l) 5 2 LiOH(aq) + H2(g) 6 1 18/01/2014 Características Gerais -Elementos do bloco s -A configuração geral destes elementos é ns1; -São muito reativos: -Reagem com a água espontaneamente e a frio, razão pela qual são guardados em frascos com derivados de petróleo ou parafina. -Esta reatividade aumenta ao longo do grupo, porque o elétron de valência fica cada vez mais afastado da atração do núcleo (sendo assim este elétron sai com maior facilidade). Características Gerais -Formam um grupo bastante homogêneo; -Todos os elementos desse grupo são metais; -São excelentes condutores de eletricidade; -São moles; -Altamente reativos; -As propriedades químicas e físicas estão intimamente relacionadas com sua estrutura eletrônica e seu tamanho; -Geralmente formam compostos univalentes, iônicos e incolores. Energia de Ionização -Primeira energia de ionização é consideravelmente menor que em qualquer outro elemento da tabela periódica; -Os átomos são muito grandes e os elétrons mais externos são fracamente atraídos pelo núcleo, logo a energia para remover estes elétrons são grandes. Características Gerais Por exemplo: Generalizando: -Reagem com a água numa reação fortemente exotérmica, libertando hidrogênio e originando uma solução alcalina (básica). Características Gerais -Todos os elementos desse grupo possuem um elétron de valência na camada mais externa; -Esse elétron é fracamente ligado ao núcleo por encontrar-se bastante afastado dele, podendo ser removido facilmente; -Os demais elétrons, por estarem mais próximos ao núcleo, são mais firmemente ligados e removidos com dificuldade. Energia de Ionização -Segunda energia de ionização é extremamente elevada (é sempre maior que a primeira) porque envolve a remoção de um elétron de um íon positivo menor e não de um átomo neutro maior; -Também implica na remoção de um elétron de um nível eletrônico totalmente preenchido. 2 18/01/2014 -Os metais alcalinos produzem diferentes óxidos ao reagirem com o O2: -Os peróxidos e superóxidos reagem também com a água da seguinte maneira: -Sob condições apropriadas todos formam óxidos normais, os quais são sólidos iônicos que reagem violentamente com a água produzindo os hidróxidos respectivos: - Apenas o Li reage com o N2 formando o nitreto de lítio: -Lítio: primeiro elemento, consideravelmente dos demais. 13 difere 14 Propriedades dos MOH -Todos são sólidos brancos deliquescentes (material que se dissolve na própria água que absorve do meio, característica encontrada nos materiais extremamente higroscópicos); -Principais: NaOH (soda cáustica) e KOH (potassa cáustica) – devido a suas propriedades corrosivas atacam a pele e o vidro. 15 Usos dos Metais Alcalinos e seus Compostos 16 Propriedades Físicas -Na fabricação de detergentes combinando-o com ácidos graxos; -Na purificação de metais fundidos; -A liga NaK é empregada como transferente de calor; -É empregado na fabricação de células fotoelétricas; -Na iluminação pública, através das lâmpadas de vapor de sódio. -Sólidos à temperatura ambiente; -Pouco duros; -Dúcteis; -Elevada condutividade elétrica que aumenta com aumento da temperatura; -Elementos do grupo 1 são os maiores dos respectivos períodos. 17 3 18/01/2014 Tamanho dos Átomos e Íons -Razões: -Os átomos dos metais alcalinos são os maiores nos seus respectivos períodos na tabela periódica; -Quando elétrons externos são removidos para formar íons positivos, o tamanho diminui consideravelmente. *A camada mais externa foi totalmente removida; *Com a remoção de 1 elétron, a carga positiva do núcleo passa a ser maior que a soma da carga dos elétrons remanescentes, de modo que cada um deles é atraído mais fortemente pelo núcleo, logo o tamanho diminui mais ainda. Propriedades Químicas Propriedades Químicas -Não se encontram livres na natureza devido à sua extrema reatividade; -Apresentam a 1ª energia de ionização pequena, o que indica, por parte do núcleo, uma atração fraca, sobre o único elétron de valência; -Formação de ligações metálicas e iônicas; -Expostos ao ar oxidam-se rapidamente; -Formam íons monopositivos; -Apresentam brilho metálico; -Guardam-se ao abrigo do ar (em petróleo ou tolueno, numa atmosfera inerte); -Pequenos valores de eletronegatividade Cor dos Compostos -Todos são brancos; -Exceto aqueles em que o ânion é colorido; Na2[CrO4] : amarelo -A presença do ânion [CrO4]- dá cor ao composto. 23 4 18/01/2014 Reação com Água Reação com Ar -Todos os metais alcalinos reagem com água, liberando H2 e formando hidróxidos; -A reação se torna cada vez mais vigorosa descendo o grupo. -Li: reage a uma velocidade moderada; -Na: funde na superfície da água e o metal fundido desliza vigorosamente, podendo inflamar-se; -K: funde e sempre se inflama. -Metais alcalinos são quimicamente muito reativos; -Perdem o brilho quando expostos ao ar; -Na, K, Rb e Cs: formam óxidos de vários tipos; -Li: forma uma mistura de óxido e nitreto Li3N (cor vermelho-rubi). 25 -Os metais alcalinos são fortes agentes redutores 26 Teste de Chama -Os metais alcalinos emitem cores características quando colocados em uma chama à alta temperatura. - A capacidade que uma espécie tem de tirar elétrons de outra espécie é medida pelo potencial de redução, Eo . 27 28 -Como resultado das baixas energias de ionização, quando os elementos do grupo são irradiados com luz, a energia luminosa absorvida pode ser suficientemente elevada para fazer com que o átomo perca um elétron. Este é denominado fotoelétron. Teste de Chama -Os elétrons podem ser facilmente excitados para um nível de energia superiores pelo calor da chama, quando esse elétron retorna ao nível energético inicial ele libera a energia absorvida. Ensaio de chama para o Li (vermelho), Na (amarelo) e K (lilás). 29 -A energia é emitida na forma de luz visível, provocando o aparecimento de cores características na chama. 30 5 18/01/2014 Solubilidade e Hidratação -Todos os sais simples se dissolvem em água formando íons, logo conduzem corrente elétrica; -Condução de corrente elétrica: Cs+>Rb+>K+>Na+>Li+. -Li é muito pequeno muito hidratado, logo o raio do íon hidratado será grande e ele se difundirá lentamente; -Cs+ é o menos hidratado o raio do íon hidratado é menor do que o do Li + hidratado, logo Cs + se move mais rapidamente e conduz mais eficientemente a corrente elétrica. Ocorrência e Obtenção -Os metais desse grupo são reativos demais para serem encontrados livres na natureza. -Na, K são abundantes na crosta terrestre, mas a obtenção dos metais requer muita energia. 31 3Li Lítio 32 Lítio Configuração eletrônica: 1s2 2s1 ou [He] 2s1 -Obtém-se por eletrólise do cloreto de lítio fundido ou a partir dos respectivos haletos por reação com sódio. 33 -Sais insolúveis ou pouco solúveis em água (exceto LiOH); 34 Reação com o Oxigênio -Ponto de fusão e ebulição elevados -É mais duro que os outros elementos do grupo1. -Haletos de lítio são solúveis em solventes orgânicos; Reação com o Nitrogênio -Sais insolúveis ou pouco solúveis em água (exceto LiOH); 6 18/01/2014 Aspectos Biológicos Aplicações do Lítio -Geração de hidrogênio e o LiOH para absorver CO2; -Sais de lítio intervém no tratamento da doença maníaco-depressiva; -Tem usos medicinais, pois afeta o equilíbrio entre Na+ e K+ e entre Mg2+ e Ca2+ no organismo; -Fabricação de graxas lubrificantes para automóveis; - O carbonato de lítio é também usado para endurecer o vidro; -É usado na fabricação de ligas metálicas, vidro, lubrificantes e baterias. Sódio -Funcionamento do íon lítio parece bloquear o processo enzimático que usa o íon magnésio; -Bloqueio da libertação da noradrenalina. Sódio 11Na Configuração eletrônica: 1s2 2s1 2p6 3s1 ou [Ne] 3s1 É obtido por eletrólise do cloreto de sódio 39 Compostos de Sódio 40 Obtenção de Sódio -Cloreto, o peróxido, o tetraborato, os silicatos, o clorato, o tiossulfato e o hidróxido de sódio; -Pode ser obtido a partir da eletrólise de uma mistura fundida de 40% de NaCl e 60% de CaCl2. -Forma ligas com metais tal como chumbo e mercúrio; -O sódio é obtido a partir de NaCl fundido (p.f 801º C); -Reduz muitos óxidos de outros metais e utiliza-se muitas vezes como agente redutor, tal como o seu hidreto. 7 18/01/2014 Obtenção dos Compostos de Sódio Reatividade Reação com água -O sódio ao reagir com a água origina hidrogênio e hidróxidos alcalinos Reação com oxigênio 43 Aspectos Biológicos Preparo de Outros Metais -O Na é um elemento biológico essencial aos animais superiores; -A diferença na relação de concentrações Na/K nos fluidos intercelulares e extracelulares é responsável pelo transporte de íons através das membranas celulares, pela regulação da pressão osmótica dentro da célula, pela transmissão de impulsos nervosos e por outras funções eletrofisiológicas - sódio é um elemento biológico essencial aos animais superiores. Na(l) + KCl(l) TiCl4(l) + 4Na(s) NaCl(l) + K (g) 4NaCl(s) +Ti(s) -Produção de tetraetilechumbo (gasolina “super”) 4NaPb(s) +4C2H5Cl(g) 3Pb(s) + NaCl(s) + (C2H5)4Pb( l ) 45 Derivados 46 Derivados -Cloreto de sódio: constitui a principal matéria-prima para a obtenção dos outros sais; -Hidróxido de sódio: utiliza-se correntemente como reagente industrial, no fabrico de sabão, celulose, papel e muitos outros produtos; -Peróxido de sódio: é um agente oxidante muito utilizado como branqueador de fibras têxteis. 47 -Tetraborato de sódio: emprega-se fabrico de detergentes; no -Os silicatos no fabrico de vidros; -Clorato de sódio: no fabrico de explosivos; -Tiossulfato de sódio: é utilizado em fotografia como revelador 48 8 18/01/2014 Carbonato de Sódio Na2CO3 Cloreto de Sódio -Constitui o sal das cozinhas e do soro fisiológico. -É um composto inorgânico muito utilizado; Obtenção -É um sal branco também conhecido "barrilha" ou"soda”. -Extraído de depósitos sub-terrâneos; -Extração pode ser bombeando água no depósito e retirar a solução saturada de cloreto de sódio; -A evaporação da água do mar em salinas é o processo de extração muito utilizado. Exemplo: fabricação de sabão, vidro e tintas. 49 Hidrogenocarbonato de Sódio Na2HCO3 50 Aplicações -Componente de extintores de pó seco: 2NaHCO3(s) Na2CO3(aq) + CO2(g)+H2O(g) *Gases extintores -Também designado bicarbonato de sódio; -Potente tampão produzido pelo organismo. Obtenção -Farmácia: anti-ácido; -Preparado borbulhando CO2 numa solução saturada de carbonato de sódio: Na2CO3(aq) + CO2(g) + H2O(l) 2NaHCO3(s) -Culinária: anti-ácido e fermento - Indústria farmacêutica: comprimidos efervescentes 51 52 -O potássio metálico é obtido, pela eletrólise do hidróxido de potássio. Potássio 19K Aspectos Biológicos Configuração eletrônica: 1s2 2s1 2p6 3s2 3p6 4s1 ou [Ar] 4s1 -Tem papel importante em inúmeras reações biológicas, desde a transmissão de impulsos nervosos à contração muscular. 53 - Alterações da quantidade de potássio e sódio, e seus compostos, nos organismos vivos têm normalmente efeitos nefastos ao nível do metabolismo. 54 9 18/01/2014 Cloreto de Potássio - KCl Aplicações: -Progressivamente substituído pelo sódio, na maior parte dos sais com aplicações industriais ao nível tecnologia dos reatores nucleares. -Constituinte de fertilizantes -Indispensável ao desenvolvimento das plantas, encontrando-se em diferentes tipos de solos, em diversas formas e com diferentes graus de solubilidade: o íon potássio é absorvido pelo solo através dos compostos do húmus, ou por intermédio de argilas ou zeólitas naturais. -A deficiência do elemento no solo implica um atrofiamento das plantas, principalmente das suas raízes. 55 -Extraído de depósitos de antigos lagos secos, a maioria das quais encontra-se atualmente no subsolo profundo. -Este íon (K+) é essencial ao crescimento das plantas, contrabalançando a carga negativa associada a algumas unidades protéicas. 56 -Sulfato potássio: utiliza-se como aditivo do gesso para controlar a sua velocidade de endurecimento e a sua resistência; -Cloreto de potássio: constitui a principal fonte para a obtenção de outros sais; -A maioria de KCl é usado com fertilizante. Na(l)+ KCl(l) NaCl(l) + K(g) -Mantém a pressão osmótica dentro das células, evitando o colapso, bombeando K+, para o seu interior. -K+ e Na+ constituem o potencial elétrico através da membrana celular. 57 -Outros sais menos vulgares são utilizados em medicina; o brometo como sedativo, o permanganato de potássio como bactericida, etc; -KCl, K2SO4, KNO3 - cloreto de potássio, sulfato de potássio e nitrato de potássio utilizados como fertilizantes; -KNO3 - nitrato de potássio - é utilizado também em explosivos; -KOH é usado na fabricação de fosfatos de potássio e de sabões moles como o estearato de potássio, ambos constituintes de detergentes líquidos. -Hidróxido de potássio: reagente industrial no fabrico de sabões líquidos, como eletrólito em certas pilhas e como absorvente de dióxido de carbono e sulfureto de hidrogênio. 58 Rubídio 37Rb Configuração eletrônica: [Kr] 5s1 59 10 18/01/2014 Aplicações -Poucas: -Utilizados em tubos de vácuo e células fotoelétricas; -Alguns compostos são utilizados na preparação de soporíferos, sedativos e no tratamento de epilepsia; -Carbonato de rubídio (RbCO3) é utilizado na indústria vidreira. -É um objeto de investigação intensa, no que se refere ao seu potencial uso como meio de transmissão de calor em veículos espaciais; -Usado como fontes de íons em foguetes espaciais, como combustível em motores de propulsão iônica e como eletrólito em baterias alcalinas para baixas temperaturas. 61 62 Césio 55Cs Configuração eletrônica: [Xe] 6s1 63 Aplicações 64 Francio -Apresenta forte efeito fotoelétrico devido à sua energia de ionização muito baixa sendo aplicado em fotocelas de fotocondutividade. 87Fr Configuração eletrônica: [Rn] 7s1 65 -É o elemento mais instável que se conhece; -Resultante da desintegração radioativa do actínio; -A sua química tem sido pouco estudada, mas tudo leva a crer que se assemelha à dos restantes membros da família, em particular à dos elementos mais pesados, como o rubídio e o césio 11 18/01/2014 Diferenças entre o Li e os demais elementos do Grupo 1 -Exceto pelo fato de ter o mesmo nox, os compostos de Li se assemelham muito mais aos elementos do grupo 2 (especialmente o Mg); -O Li é bem mais duro que os demais Metais Alcalinos; -p.f. e p.e. do Li é muito mais elevado que os demais elementos do grupo; -Li reage menos facilmente com o oxigênio formando óxido; 67 -Li forma um nitreto, nenhum outro elemento do grupo 1 forma nitretos mas, elementos do grupo 2 formam; -Li reage diretamente com C, formando carbeto iônico, nenhum outro metal alcalino apresenta esta propriedade mas, todos os elementos do grupo 2 reagem com C; -Li apresenta maior tendência de formar complexos que os metais alcalinos mais pesados; -Li+ e seus compostos são mais fortemente hidratados que os compostos dos demais elementos do grupo. 68 Referências Bibliográficas -SHRIVER, D.F.; ATKINS, P.W. Química Inorgânica. 4ª ed. Porto Alegre: Bookman, 2011. -LEE, J. D. Química inorgânica não tão concisa. 5.ed. São Paulo: Edgard Blucher, 1999. -ATKINS, P.W.; JONES, L. Princípios de Química. 3ª ed. Porto Alegre: Bookman, 2007. 12
Download