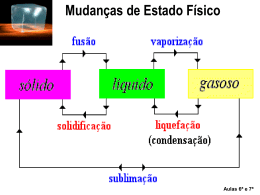
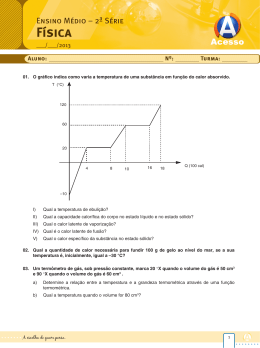
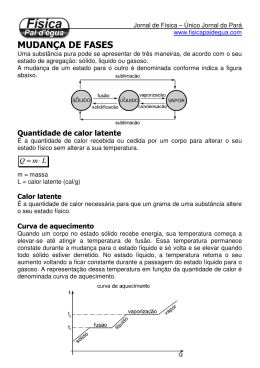
Fases da matéria Considera-se que a matéria se apresenta em três estados distintos: sólido, líquido e gasoso. Fases da matéria A tabela mostra algumas características físicas de cada fase: Fases da matéria Uma substância pode passar de uma fase para outra recebendo ou cedendo calor. Fases da matéria Outra figura para ilustrar as mudanças de fase. Fusão Exemplo: fusão do gelo 1ª Lei: sob pressão constante a fusão de uma substância se processa à temperatura constante. 2ª Lei: para uma dada pressão, cada substância possui sua própria temperatura de fusão. A temperatura de fusão de cada substância varia com a mudança de pressão. Durante a fusão, a maioria das substâncias sofre aumento de volume. Algumas, no entanto, como a água, apresentam comportamento inverso. Influência da pressão na fusão 1º caso: a substância 2º caso: a substância diminui aumenta de volume ao de volume ao fundir-se (o fundir-se (a maioria das caso da água) substâncias) Vaporização Pode ocorrer de três formas: Evaporação – quando a passagem da forma líquida para a forma gasosa ocorre de maneira lenta na superfície do líquido. Ebulição – quando a passagem da forma líquida para a forma gasosa ocorre de forma difusa em todo o líquido. Calefação – quando a passagem da forma líquida para a forma gasosa ocorre de forma brusca, em uma temperatura superior à do líquido. Influência da pressão na vaporização 1ª Lei: sob pressão constante, a ebulição de uma substância se processa à temperatura constante. 2ª Lei: para uma dada pressão, cada substância possui sua própria temperatura de ebulição. A temperatura de ebulição de cada substância varia com a mudança de pressão. A água (novamente!) não entra em ebulição à mesma temperatura em São Paulo e em La Paz devido à diferença de pressão atmosférica entre as cidades. Influência da pressão na vaporização O gráfico a seguir mostra como a pressão atmosférica varia com a altitude: Calor latente ou calor latente específico O calor latente provoca apenas a mudança de fase de uma substância, sem alterar sua temperatura. A quantidade de calor que 1 grama de uma substância precisa ganhar ou perder para mudar de fase é denominada calor latente específico, ou simplesmente calor latente. Q L = → Q = L⋅m m Unidade no SI : cal/g L: calor latente da substância Q: quantidade de calor recebida ou cedida m: massa da substância Aplicações 1) Considere um recipiente termicamente isolado contendo inicialmente 200 g de gelo a – 10 °C. Determinar a quantidade de calor que essa massa de gelo deve receber para se transformar em 200 g de água líquida a 20 °C, dados: calor específico do gelo = 0,5 cal/ g.°C; calor específico da água = 1 cal/g.°C; calor latente de fusão do gelo = 80 cal/g) Aplicações 2) Uma pedra de gelo a 0 °C é colocada em 200 g de água a 30 °C, num recipiente de capacidade térmica desprezível e isolado termicamente. O equilíbrio térmico se estabelece em 20 °C (dados: calor específico da água = 1 cal/g.°C; calor latente de fusão do gelo 80 cal/g). Qual é a massa da pedra de gelo?
Download