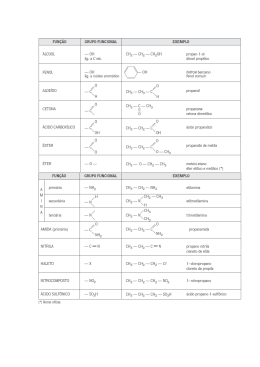
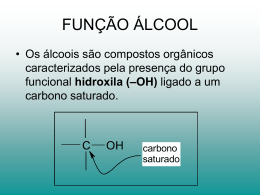
Apostila de Química Profª Fátima Serrado CMB -1- Apostila de Química CMB Química Orgânica 6C: Em 1858, Kekulé apresenta a Teoria da Valência, que deu à química orgânica uma excelente ferramenta ao reconhecer o hidrogênio, oxigênio e carbono como, respectivamente monovalente, bivalente e tetravalente. Os princípios de Kekulé são: a) O átomo de carbono é tetravalente e as valências são iguais; b) Um átomo de carbono é capaz de ligar-se a outro, formando cadeias; Em 1874, Van’t Hoff e Le Bell propuseram uma estrutura tetraédrica para o átomo de carbono, que dizia que o átomo de carbono situa-se no centro de um tetraedro imaginário, estando cada uma de suas valências dirigida para um dos vértices do tetraedro. Com esse modelo, os diferentes tipos de ligação que ocorrem com os átomos de carbono foram representados da seguinte maneira: 1s2 2s2 s s 2p2 px py pz 1e 6C: 1s2 2s1 s s 2p3 px py pz - Nos compostos em que o carbono faz ligações covalentes comuns do tipo sigma (4σ) todas as ligações são iguais, já que necessitam de uma mesma quantidade de energia para serem rompidas. Na geometria espacial prova-se que o ângulo máximo entre 4 eixos que partem de um mesmo ponto é de 109°28' (cento e nove graus e vinte e minutos). Podemos visualizar esse arranjo, imaginando o núcleo do átomo carbono posicionado no centro de uma pirâmide tetraédrica e os 4 orbitais orientados em direção aos 4 vértices da pirâmide. Hibridação sp2 do carbono Verifica-se que em diversos compostos o carbono estabelece três ligações covalentes do tipo sigma (σ) e uma ligação covalente do tipo pi (π), isto é, duas: ligações simples e uma ligação dupla. Por exemplo, na molécula de gás eteno, C 2H4. Cada átomo de carbono pode ligar-se a um outro átomo de carbono por intermédio de um, dois ou três pares covalentes, formando o que chamamos de ligação simples, ligação dupla e ligação tripla. – 4 ligações simples: Sabemos que a ligação pi (π) é feita apenas entre orbitais atômicos puros do tipo p que se interpenetram segundo eixos paralelos. Assim, segundo esse modelo, para fazer a ligação pi (π), o átomo de carbono utiliza um de seus orbitais p puros (por exemplo, o orbital pz). – 2 ligações simples e uma dupla: – 1 ligação simples e uma tripla: Já para fazer as 3 ligações sigma (σ) que são iguais e de mesma energia, admite-se que deve ocorrer uma hibridização entre o orbital s e os 2 orbitais, px e py, do nível mais externo do carbono no estado fundamental, originando orbitais novos e iguais, denominados sp2. – 2 ligações duplas: Hibridação de orbitais Hibridação sp3 • Carbono no estado ativado: 2 2 2 1 2p2 6C: 1s 2s 6C: 1s 2s Um elétron de seu orbital sofre uma transição para o orbital 2pz que estava vazio, já que a diferença de energia entre esses orbitais não é muito acentuada. Esse estado, apenas teórico, é denominado estado ativado: 6C: 2 1s 2s s s 2 2 2p px py pz 1e 6C: 2 1s 2s s s 1 s px py pz 1e 3 2p - • Carbono no estado híbrido: 2 2(sp2)3 2p 6C: 1s px py pz - Profª Fátima Serrado s s sp2 sp2 sp2 pz -2- s s 2p3 px py pz Apostila de Química CMB Hibridação sp do carbono O carbono também pode fazer duas covalentes do tipo sigma (σ) duas covalentes do tipo pi (π), isto é, duas duplas ou uma ligação simples e uma tripla,como por exemplo, nas moléculas carbônico, ou gás acetileno, C2H2. ligações ligações ligações ligação de gás A ligação pi (π) é feita apenas entre orbitais atômicos puros do tipo p que se interpenetram segundo eixos paralelos. Assim, para fazer as duas ligações pi (π), o átomo de carbono utiliza dois seus orbitais p puros (por exemplo, o orbital py e o orbital pz. Já para fazer as duas ligações sigma (σ) que são iguais e de mesma energia, admite-se que deve ocorrer uma hibridização entre o orbital s e um orbital, por exemplo, o orbital px, do nível mais externo do carbono no fundamental, originando 2 orbitais novos e iguais, denominados sp. Teoricamente esse processo pode ser representado da seguinte forma: 2 2 2 1 2p2 6C: 1s 2s 2p3 6C: 1s 2s s s px py pz 1e s s px py pz - 6C: 1s2 2(sp)2 2p2 s sp sp py pz Quando o Carbono apresentar apenas ligações simples, este carbono possui hibridização sp3. Quando o Carbono apresentar uma ligação dupla e as outras duas simples, este carbono possui hibridização sp2. Quando o Carbono apresentar uma ligação tripla e a outra simples ou duas duplas, este carbono possui hibridização sp. Tipos de Carbono Os átomos de carbono que fazem parte de uma cadeia podem ser classificados em função do número de átomos de carbono ligados diretamente ao átomo que se deseja classificar. Nas cadeias carbônicas podem aparecer quatro tipos de átomo de carbono. Representação das Moléculas Orgânicas As moléculas orgânicas podem ser representadas indicando-se os átomos de carbono e de hidrogênio ou não. carbono primário: ligado diretamente, no máximo, a outro átomo de carbono. carbono secundário: ligado diretamente a apenas dois outros átomos de carbono. carbono terciário: ligado diretamente a três outros átomos de carbono. carbono quaternário: ligado diretamente a quatro átomos de carbono. CLASSIFICAÇÃO DAS CADEIAS CARBÔNICAS Quando só tivermos ligações simples nas moléculas teremos apenas ligações do tipo δ (sigma) e quando temos ligações duplas e triplas, teremos respectivamente além da ligação δ (sigma), uma e duas ligações (pi). Profª Fátima Serrado -3- Apostila de Química CMB Classificação das Cadeias Carbônicas Quanto à natureza dos átomos a) cadeia homogênea: quando existem átomos de carbono. na cadeia, só b) cadeia heterogênea: quando na cadeia, além dos átomos de carbono, existem outros átomos diferentes do carbono, introduzidos no meio da cadeia carbônica. São os chamados heteroátomos, dos quais os mais frequentes são O, S, e N. Cadeia aberta, acíclicas ou alifáticas São aquelas em que existem pelo menos dois carbonos primários, que constituem as extremidades da cadeia, ou seja, quando o encadeamento dos átomos não sofre nenhum fechamento. Quanto à disposição dos átomos Cadeia fechada ou cílclica Ocorrem quando há um fechamento na cadeia, formando-se um ciclo, núcleo ou anel. a) cadeia normal: quando o encadeamento segue uma sequência única. a) cadeias fechadas normais: o anel não apresenta ramificações CUIDADO: não existem cadeias retas, pois os átomos de carbono, unidos por quatro ligações simples, dispõem-se em ziguezague, formando ângulos de 109º28’. b) cadeias fechadas ramificadas: ao anel se ligam ramificações b) cadeia ramificada: quando na cadeia surgem “ramos” ou “ramificações”. Quanto a saturação dos átomos de carbono a) cadeias saturadas: quando os átomos de carbono estão ligados somente por ligações simples. b) cadeias insaturadas: os átomos de carbono são ligados também por ligações duplas ou triplas. Profª Fátima Serrado Quanto a disposição dos átomos de carbono Quanto a saturação dos átomos de carbono a) cadeias saturadas: os carbonos apresentam somente ligações simples. do anel b) cadeias insaturadas: os carbonos apresentam ligações duplas ou triplas do anel -4- Apostila de Química CMB Isolados Condensados Quanto à natureza dos átomos constituintes a) cadeias homogêneas ou homocíclicas: constituídas por apenas átomos de carbono são Exercícios b) cadeias heterogêneas ou heterocíclicas: apresentam átomos de outros elementos (heteroátomos) entre os átomos de carbono, sendo os mais freqüentes O, S e N. 1. Centec-BA - Na estrutura representada a seguir, os carbonos numerados são, respectivamente: a) b) c) d) e) sp2, sp, sp2, sp2, sp3. sp, sp3, sp2, sp, sp4. sp2, sp2, sp2, sp2, sp3. sp2, sp, sp, sp2, sp3. sp3, sp, sp2, sp3, sp4. Cadeias aromáticas Possuem, em sua estrutura, o chamado anel ou núcleo benzênico, que é um sistema hexagonal insaturado: Este anel aparece na substância chamada benzeno, comercialmente denominada benzol. As cadeias aromáticas podem ser classificadas como: a) cadeias mononucleares: apresentam apenas um anel benzênico. 2. Sobre este composto pode-se afirmar que: a) b) c) b) cadeias polinucleares: apresentam dois ou mais anéis benzênicos. Conforme a disposição dos anéis, teremos núcleos isolados, onde os anéis estão ligados por uma unidade de valência e núcleos condensados, onde os anéis de fundem e apresentam pelo menos dois átomos de carbono comuns aos anéis. d) tem fórmula ângulos de carbono; tem fórmula ângulos de carbono; tem fórmula ângulos de carbono; tem fórmula ângulos de carbono. molecular C18H20, 9 ligações pi (π) e 109º entre as ligações carbonomolecular C18H18, 9 ligações pi (π) e 120º entre as ligações carbonomolecular C18H16, 9 elétrons pi (π) e 109º entre as ligações carbonomolecular C18H20, 9 elétrons pi (π) e 120º entre as ligações carbono- 3. ESPCEX-2002 - A molécula do 2,2,3-trimetil pentano apresenta: a) 2 carbonos primários, 1 secundário, 3 terciários e 2 quaternários. 2 carbonos primários, 3 secundários e 3 terciários. b) Profª Fátima Serrado U.F.Uberlândia-MG - O anuleno é um hidrocarboneto aromático que apresenta a seguinte fórmula estrutural simplificada: -5- Apostila de Química c) d) e) 4. 5 1 3 1 5 carbonos primários, 1 secundário, 1 terciário e quaternário. carbonos primários, 3 secundários, 1 terciário e quaternário. carbonos primários e 3 secundários. CMB 9. Uma das variedades de náilon pode ser obtida a partir da matéria-prima denominada caprolactana, que apresenta a seguinte fórmula estrutural: Observando-se a fórmula estrutural acima e com base na nomenclatura oficial dos compostos orgânicos (IUPAC) o limoneno é denominado: A respeito dessa substância, pede-se: a) sua fórmula molecular; b) a classificação da sua cadeia. 5. a) b) c) d) e) aromática e heterogênea. ramificada e homogênea. insaturada e cíclica. aromática e homogênea. acíclica e heterogênea. Construa a fórmula estrutural dos seguintes hidrocarbonetos: a) 2,3-dimetil-1-penteno; b) 3-etil-2-metil-2-hexeno; c) 4,4-dimetil-1-pentino; d) 3-isopropil-1-hexino; e) 2,3,3-trimetil-1,4-pentadieno. 7. a) b) c) d) e) UEFS-BA A fórmula estrutural acima representa a metionina, um aminoácido importante para as funções hepáticas. A cadeia desse composto pode ser classificada como: 6. UFF/1-2000 - O Limoneno, um hidrocarboneto cíclico insaturado, principal componente volátil existente na casca da laranja e na do limão, é um dos responsáveis pelo odor característico dessas frutas. MACK-SP - O nome (IUPAC) para o composto 1-metil-4-(isopropenil)cicloexeno 1-metil-2-(4-propenil)cicloexeno 1-(isopropenil)-4-metil-cicloexeno 1-metil-4-(1-propenil)cicloexeno 1-(isopropenil)-4-metil-3-cicloexeno HIDROCARBONETOS Os compostos da função hidrocarboneto apresentam moléculas formadas somente por carbono e hidrogênio, sendo que C e H constituem o seu grupo funcional. Nomenclatura Prefixo + saturação + sufixo Os prefixos são extraídos do numeral grego ou latino. 1 2 3 4 5 C C C C C – Met – Et – Prop – But – Pent 6 C – Hex 7 C – Hept 8 C – Oct 9 C – Non 10 C – Dec 11 12 20 30 40 C C C C C – Undec – Dodec – Icos – Triacont – Tetracont A saturação é definida de acordo com o tipo de ligação ente os carbonos. AN – Cadeia saturada EN – Uma dupla-ligação IN – Uma tripla ligação a) 5, 5-dimetil-2-hexino. b) 5-etil-2-hexeno. c) 2, 2, 5-trimetil-4-penteno. d) 2-metil-2-hepteno. e) 5, 5-dimetil-2-hexeno. 8. Caso apareça mais de uma dupla ou tripla ligação na cadeia, os termos DI, TRI, etc. devem anteceder En ou IN. Exemplo DIEN – duas duplas TRIEN – três duplas UFRS - O alcatrão da hulha é uma fonte de: DIIN – duas triplas TRIIN – três triplas a) hidrocarbonetos alifáticos. b) gases combustíveis. c) óleos comestíveis. d) compostos aromáticos. e) hidrocarbonetos alicíclicos. Profª Fátima Serrado -6- Apostila de Química Ramificações As ramificações são grupos orgânicos cujo nome é formado por um prefixo, que indica o úmero de carbono, e sufixo IL, conforme a tabela a seguir: CMB Observação: na determinação do sentido de numeração da cadeia, os números nos nomes são separados entre si por vírgula e, das letras, por hífen. Não se coloca hífen entre o nome do grupo orgânico e o nome da cadeia principal. O sufixo está associado a cada uma das funções orgânicas. Cada função possui um sufixo diferente, como veremos a seguir. Portanto, quando encontramos um nome, de acordo com a IUPAC, devemos dividi-lo em três partes: CH3 – CH2 – CH2 – CH2 – CH3 PENTANO = PENT nº de C AN O saturação hidrocarboneto Alcanos ou Hidrocarbonetos Parafínicos São hidrocarbonetos acíclicos e saturados. Apresentam como fórmula geral CnH2n + 2, em que n é um número inteiro. Exemplo: CH4; C2H6; C3H8; C4H10; C5H12 A nomenclatura para os alcanos fica: PROPANO = PROP AN 3C saturado O hidrocarboneto CH3 – CH2 – CH3 = n-PROPANO CH3 – CH2 – CH2 – CH3 = n-BUTANO (n = normal) Alcenos – Alquenos – Olefinas ou Hidrocarbonetos Etilênicos São hidrocarbonetos acíclicos, contendo uma dupla-ligação. Apresentam fórmula geral CnH2n, com n ≥ 2. Exemplo: C2H4; C3H6; C4H8 A nomenclatura é semelhante à dos alcanos, apenas trocando o termo que indica saturação AN por EN. CH2 = CH2 ETENO = ET EN O 2 C alceno hidrocarboneto Devemos numerar as cadeias mais longas pela extremidade mais próxima da dupla-ligação. Ao citar o nome, também devemos colocar a posição da dupla-ligação. Exemplo: 1CH2 = 2CH – 3CH2 – 4CH3 1-BUTENO 1 Os grupos orgânicos são colocados em ordem alfabética: alil < benzil < butil < sec-butil < terc-butil < etil < fenil < isobutil < isopropil < metil < propil < vinil. CH3 – 2CH = 3CH – 4CH3 2-BUTENO Observação: Quando encontramos hidrocarbonetos com mais de uma dupla-ligação, a cadeia principal é a mais longa possível que contenha as duplasligações. A numeração da cadeia principal deve ser feita de modo que as duplas fiquem com os menores números possíveis. 1 CH2 – 2CH = 3CH = 4CH – 5CH3 (Alcadieno) 2,3 –Pentadieno Profª Fátima Serrado -7- Apostila de Química CMB Note que o termo que indica a saturação é precedido pelo prefixo DI, duas duplas. CH3 H26C = 5CH – 4CH = 3CH – 2CH = 1CH2 (Alcatritrieno) 1,3,5 – Hexatrieno CH2CH3 Alcinos, Alquinos ou Hidrocarbonetos Acetilênicos CH3 São hidrocarbonetos acíclicos, contendo uma única tripla ligação. A sua fórmula geral pode ser representada por CnH2n – 2’ em que n 2. Exemplos: C2H2 ; C3H4 ; C4H6 ; C5H8 As regras de nomenclatura são as mesmas dos alcenos e alcapolienos, apenas trocando o termo que indica a saturação EN por IN. Exemplos: ETINO = ET IN O 2 C alcino hidrocarboneto PROPINO = PROP 3C 1 IN 1,3-dimetilbenzeno p-dimetilbenzeno (m-xileno) H3 C 1-isopropil-4-metilbenzeno p-dimetilbenzeno (cimeno) Exercícios: 1. Dê o nome oficial, em ordem alfabética, do hidrocarboneto cuja fórmula estrutural é dada a seguir: 2. Construa a fórmula estrutural dos seguintes hidrocarbonetos: O alcino hidrocarboneto CH ≡ 2C – 3CH2 – 4CH3 1-BUTINO 1 1-etil-2-metilbenzeno o-etilmetilbenzeno CH3 – 2C ≡ 3C – 4CH3 2-BUTINO Hidrocarbonetos aromáticos A nomenclatura dos hidrocarbonetos é derivada do anel principal com adição dos nomes dos grupos orgânicos. Observe os compostos abaixo. CH3 3. Metilbenzeno (tolueno) Benzeno CH = CH3 CH3 isopropilbenzeno (cumeno) CH3 CH3 H3C a) 5, 5-dimetil-2-hexino. b) 5-etil-2-hexeno. c) 2, 2, 5-trimetil-4-penteno. d) 2-metil-2-hepteno. e) 5, 5-dimetil-2-hexeno. 1,3,5-trimetilbenzeno (mesitileno) Nos derivados do benzeno com dois substituintes (grupos orgânicos), nós podemos usar os prefixos: orto (o) para a posição 1,2; meta (m) para a posição 1,3; para (p) para a posição 1,4. Profª Fátima Serrado MACK-SP - O nome (IUPAC) para o composto H3 C Vinilbenzeno (estireno) CH a) 2,3-dimetil-1-penteno; b) 3-etil-2-metil-2-hexeno; c) 4,4-dimetil-1-pentino; d) 3-isopropil-1-hexino; e) 2,3,3-trimetil-1,4-pentadieno. HIDROCARBONETOS DE CADEIA FECHADA Cicloalcano, Ciclano ou Cicloparafina São hidrocarbonetos cíclicos e saturados. Apresentam como fórmula geral CnH2n com n ≥ 3. Exemplos: C3H6 ; C4H8 ; C5H10 Cicloalcanos com somente um anel são nomeados pela união do prefixo ciclo aos nomes dos -8- Apostila de Química CMB alcanos que possuem o mesmo número de átomos de carbono. A estrutura do benzeno pode ser representada: Exemplos As estruturas apresentadas diferem apenas no arranjo dos elétrons, ou seja, observa-se uma deslocalização dos elétrons, que recebe o nome de ressonância. O benzeno é um híbrido das duas estruturas que, por questão de comodidade, representaremos por um hexágono regular com um círculo no interior; subentende-se que a cada vértice do hexágono se encontra ligado um átomo de hidrogênio, a menos que se indique a existência de outro átomo ou grupo de átomos. Cicloalcenos, Cicloalquenos, Ciclenos ou Ciclolefinas São hidrocarbonetos alicíclicos com uma duplaligação . A sua fórmula geral fica: CnH2n–2, com n ≥ 3. Exercícios 1. Exemplos: C3H4 ; C4H6 ; C5H8 a) ciclobutano; b) ciclopentano; c) cicloeptano; d) cicloctano. A nomenclatura é feita acrescentando o prefixo ciclo ao nome do alceno que possui o mesmo número de átomos de carbono. Exemplos Escreva as fórmulas estruturais e moleculares dos seguintes ciclanos: 2. Dê o nome dos ciclanos representados por suas fórmulas estruturais: 3. Dê o nome ou a fórmula estrutural dos seguintes cicloalquenos: 4. UFRS - O alcatrão da hulha é uma fonte de: Fórmula geral dos cicloalcanos: CnH2n As fórmulas gerais dos alquenos e dos ciclanos são iguais, o que significa que uma mesma fórmula molecular pode representar mais de uma substância: Hidrocarbonetos Aromáticos a) hidrocarbonetos alifáticos. b) gases combustíveis. c) óleos comestíveis. d) compostos aromáticos. e) hidrocarbonetos alicíclicos. São os que possuem um ou mais núcleos benzênicos. A estrutura fundamental dos aromáticos é o benzeno. Profª Fátima Serrado -9- Apostila de Química CMB Cl FUNÇÕES ORGÂNICAS Haletos Cloreto de fenila São compostos derivados dos hidrocarbonetos pela substituição de hidrogênio por halogênio (F, Cl, Br, I). Nomenclatura IUPAC Para estabelecer o nome oficial dos haletos orgânicos, os átomos de halogênios são considerados como substitutos de hidrogênios na cadeia carbônica do hidrocarboneto e sua nomenclatura segue o seguinte esquema: nome do halogênio + nome do hidrocarboneto correspondente Ex: 2 1 H34C – 3CH2 – CH – CH 3 Cl Cl Cl H – C – Cl H3C – CH2 – CH – CH3 Cl Cloreto de sec-butila Álcoois São compostos orgânicos que se formam substituindo um hidrogênio da água por um grupo alquilo (apresentam um ou mais grupos hidroxilas, – OH, ligados a átomos de carbono saturados (apresenta apenas ligações sigma) Os álcoois são mais reativos que os hidrocarbonetos e apresentam caráter praticamente neutro. Cl clorobenzeno triclorobenzeno Na nomenclatura oficial (IUPAC), para efeito de numeração da cadeia principal, os halogênios não são considerados grupos funcionais, mas, sim, como se fossem radicais. 1 2 3 Cl CH3 4 5 H3C – CH2 – CH – CH2– CH3 2-cloro-3-metilpentano Nomenclatura IUPAC Por isso, se a cadeia for insaturada, o menor número deverá ser atribuído ao carbono que apresenta a insaturação e, se houver ramificações também têm prioridade sobre os halogênios na numeração, ou seja, os radicais devem receber o menor número. Assim, temos a seguinte ordem crescente de prioridade nanumeração dos carbonos: halogênios < radicais < insaturações 6 5 4 Cl C2H5 3 2 1 H3C – CH2 – CH – CH= CH– CH3 5-cloro-4-etil-2-hexeno A numeração da cadeia principal deve ser feita a partir da extremidade mais próxima da insaturação. Nomenclatura usual Na nomenclatura dos álcoois utilizamos o grupo alquilo, precedido da palavra álcool e sufixo ol para indicar o grupo funcional –OH e devemos numerar a cadeia principal a partir da extremidade mais próxima do grupo hidroxila. Nomenclatura usual: A nomenclatura de classe funcional para álcoois é feita utilizando a palavra ÁLCOOL, seguida do nome do GRUPO ORGÂNICO (metil, etil....) ligado à hidroxila (OH-), acrescido da terminação ICO. Para álcoois de moléculas pequenas, essa nomenclatura chega a ser mais utilizada, no dia-a-dia dos químicos, do que a nomenclatura oficial. Nomenclatura de kolbe: Nesta nomenclatura a célula básica da molécula de álcool (C–OH) recebe o nome de carbinol. Os eventuais grupos a ele ligados serão tratados como radicais e recebem, portanto, em seu nome a terminação il. Nessa nomenclatura, o nome do haleto precede o nome do radical. Profª Fátima Serrado - 10 - Apostila de Química 4 3 CMB 2 2. Secundário: a hidroxila está ligada a um átomo de carbono secundário. 3. Terciário: a hidroxila está ligada a um átomo de carbono terciário. 1 H3C – CH2 – CH2 – CH2 – OH IUPAC: Butan-1-ol Usual: Álcool n-butílico Propriedades Físicas: Kolbe: n-propil-carbinol Influência da Pontes de Hidrogênio 4 H3C 2 3 1 – CH2 – CH – CH3 OH IUPAC: Butan-2-ol Usual: Álcool sec-butílico Kolbe: etil-metil-carbinol Devido a presença do grupo OH-, os álcoois são compostos polares. O oxigênio é mais eletronegativo que outro átomo de carbono ou hidrogênio. Assim, em um álcool a carga parcial positiva pode ocorrer no carbono ou no hidrogênio e a carga parcial negativa ocorre no oxigênio. CH3 1 2 3 H3C – CH – CH3 OH IUPAC: metil-propan-2-ol Usual: Álcool terc-propílico Kolbe: trimetil-carbinol 4 3 2 1 H2C = CH – CH2 – CH2 – OH IUPAC: But-3-en-1-ol OH 5 4 3 2 1 H3C – C – CH2 – C – CH2 – CH3 CH3 CH2 CH3 IUPAC: 3-etil-5-dimetilexan-2-ol Kolbe: dietil-isobutil-carbinol A atração entre a terminação positiva de uma molécula e a terminação negativa de outra, é chamada interação dipolo-dipolo. Quando o pólo positivo de um dos dipolos for o hidrogênio ligado a átomos de F,O,N, que são os átomos de maior eletronegatividade, a interação de atração entre os dipolos é particularmente forte e recebe o nome especial de ponte de hidrogênio. Pela comparação desses números, a ligação O-H da ponte de hidrogênio é mais fraca que a ligação O-H covalente. Contudo a presença de um grande número de pontes de hidrogênio na água liquida tem um importante efeito nas propriedades físicas da água. Graças a ocorrência das pontes de hidrogênio uma quantidade adicional de energia é necessária para ebulir a água e separa cada molécula das suas vizinhas. Extensas ligações com pontes de hidrogênio, também existem entre as moléculas de álcool. Classificação do álcoois: 1. Quanto do número de hidroxilas (OH-): 1. Monoálcool ou monol: quando, na molécula de álcool, existe apenas uma hidroxila 2. Diálcool ou Diol: quando existem duas hidroxilas, será um; 3. Triálcool ou Triol: quando existem três hidroxilas, 4. Poliálcool: quando existem várias hidroxilas 2. Quanto à posição da hidroxila (OH-): 1. Primário: a hidroxila está ligada a um átomo de carbono primário. Profª Fátima Serrado - 11 - Apostila de Química CMB Fenóis e Enóis OH Fenóis: são compostos orgânicos caracterizado por uma ou mais hidroxilas ligadas a um anel aromático. Apesar de possuir um grupo -OH característico de álcool, o fenol é mais ácido que o álcool, pois é mais facilmente oxidado. H2C – C = CH Sendo o oxigênio um átomo muito eletronegativo, ele atrai os elétrons da ligação π, ocasionando um rearranjo na molécula, transformando-se em um aldeído ou em uma cetona. Fenol também é o nome usual do fenol mais simples, que consiste em uma hidroxila ligada ao anel benzênico. Outros nomes para a mesma substância incluem: benzenol; ácido carbólico; ácido fénico (ou ácido fênico, no Brasil); ácido fenílico; hidroxibenzeno; monohidroxibenzeno. Sua fórmula molecular é C6H5OH OH O H2C – C = CH H2C – C – CH2 1-propen2-ol propanona O- OH Usual: fenol comum ou ácido fênico H2C = CH + H2O + H2C = CH + H3O (aq) cátion ânion hidrônio etenóxido Devido à sua instabilidade, os enóis não podem ser estudados mais detalhadamente, tanto em relação às propriedades como em relação às aplicações práticas. Quando existem mais radicais ligados ao anel aromático, eles serão prefixados de Orto (o), Meta (m) e Para (p), respectivamente, em relação à Hidroxila. Exemplo: etenol IUPAC: o-hidroxi-metil-benzeno Usual: o-cresol Éteres Usual: o-hidroxi-tolueno A função éter apresentam o grupo funcional C — O — C, denominado alcoxila. Esse composto é utilizado no produto chamado Creolina (germicida) IUPAC: m-hidroxi-metil-benzeno CH3 Usual: m-hidroxi-tolueno Nomenclatura Nomenclatura IUPAC (oficial): menor radical + oxi + nome do hidrocarboneto. Nomenclatura usual: éter + nome dos grupos orgânicos ligados ao — O — + ico. H3C – O – CH2 – CH2 – CH3 IUPAC: metoxipropano Usual: éter metil propílico Enóis : São compostos orgânicos que possuem um grupo –OH (hidróxi) ligado a um carbono que faz ligação dupla. São compostos instáveis que não existem na forma isolada. H3C – O – CH2 – CH2 – CH3 IUPAC: etoxietano Usual: éter dietílico Nomenclatura: IUPAC: prefixo + en + ol OH Ex: H2C = CH Profª Fátima Serrado H Os enóis possuem um fraco caráter ácido, como os fenóis, devido à presença da ligação π, que estabiliza o carbono do grupo –OH, quando ocorre a perda do próton H+. IUPAC: hidroxi-benzeno Usual: m-cresol etanal OH OH OH H2C – C etenol Os fenóis não seguem nenhuma regra fixa de nomenclatura. Os mais simples, no entanto, podem ser nomeados usando o anel aromático como cadeia principal e os grupos ligados a ele como radicais. CH3 O H2C = CH Nomenclatura OH 1-propen2-ol –O– etenol - 12 - Apostila de Química CMB IUPAC: fenoxibenzeno Usual: éter difenílico Há dois tipos de éteres cíclicos: Os que possuem o oxigênio ligado a dois carbonos vizinhos, que são denominados epóxidos. etanal (acetaldeído) Metanal (formaldeído) propanal (propionaldeído ) butanal (butiraldeído) Os que possuem o oxigênio ligado a dois carbonos que não sejam vizinhos. A nomenclatura deste tipo de éter cíclico não segue nenhum sistema regular (nomenclatura usual). 5-clropentanal Feniletanal (fenilacetaldeído) O grupo funcional aldeído ligado a um anel é usado com o sufixo carbaldeído. Benzenocarbaldeído (benzaldeído) Obtenção Os éteres são obtidos normalmente pela condensação de álcoois ou fenóis. Assim, o éter dietílico pode ser obtido pela condensação do álcool etílico. H3C – CH2 – O – H + H – O – CH2 –CH3 H3C – CH2 – O – CH2 – CH3 + H2O Ciclohexanocarbaldeído Caso existam dois grupos aldeídos, o sufixo usado é dial. Aldeídos propanodial Aldeídos são compostos que apresentam o grupo funcional denominado aldoxila, formila ou carbonila. O – CHO ou Nomenclatura de aldeídos de cadeia ramificada Encontra-se primeiro encontrar a cadeia principal. Numera-se pela extremidade do grupo CHO, independente das ramificações. –C 4 H 3 2 1 O H3C – CH – CH2 – C Nomenclatura IUPAC CH3 Os aldeídos são nomeados com a terminação al. O grupo funcional aldeído é considerado sempre o carbono 1 e não precisa ser enumerado. Os quatro aldeídos mais simples apresentam nomes usuais formados pelos prefixos: form, acet, propion, butir, seguidos da palavra aldeído. Profª Fátima Serrado 2-naftalenocarbaldeído 3-metilbutanal - 13 - H Apostila de Química CMB Cetonas Ácidos Carboxílicos São substâncias orgânicas oxigenadas caracterizadas por apresentar a carbonila em carbono secundário. Ácidos carboxílicos são compostos apresentam o grupo funcional carboxila : O que H3C–CH O ou –C –C– Podemos também definir cetonas como substâncias derivadas de álcoois secundários por desidrogenação, portanto oxidação de álcoois secundários. – COOH OH Nomenclatura IUPAC Usa-se a palavra ácido seguida do nome do hidrocarboneto correspondente com a terminação “ico”. A numeração deve começar pelo carbono do grupo funcional Nomenclatura IUPAC As cetonas são nomeadas com a terminação ona. A cetona de menor cadeia carbônica é a propanona, conhecida como acetona. A cadeia principal é enumerada para dar ao grupo cetônico o menor número possível. O carbono 1 será sempre o carbono da carboxila. Em caso de duas, o carbono 1 será a que der os menores números para as ramificações e depois para as insaturações. Em caso de duas Carboxilas, usa-se o prefixo DIÓICO, sem necessidade de informar posição, pois as mesmas sempre se encontram na extremidade das cadeias. Caso o ácido seja ramificado, pode-se indicar as posições 2, 3 e 4 com as letras gregas , β e γ, respectivamente. Geralmente esta numeração é utilizada em ácidos com apenas uma ramificação e não é muito usada atualmente, não podendo ser usada para indicar posição de insaturações. Usual Nomenclatura Usual A nomenclatura usual das cetonas parece com a nomenclatura de Kolbe (dos álcoois). Denomina-se o carbono da carbonila como cetona e coloca-se os nomes dos radicais presos a ela. Esta nomenclatura não é possível de ser feita em Cetonas com mais de uma carbonila. Alguns ácidos carboxílicos possuem nomenclatura usual, que geralmente está associada a sua fonte natural. Exemplos: O IUPAC: Ácido Metanóico Usual: Ácido Fórmico (origem: formiga e abelha) H–C O OH O IUPAC: butanona Usual: etil-metil-cetona H3 C – C OH O –C– – CH3 O H3C – CH2 – C Usual: fenil-p-toluil-cetona Em caso de existir mais de uma possibilidade para a posição da carbonila, sua posição deve ser indicada fazendo com que o carbono 1 seja aquele que estiver na extremidade mais próxima da carbonila. Profª Fátima Serrado IUPAC: Ácido Etanóico Usual: Ácido Acético (origem: vinagre) IUPAC: Ácido Propanóico Usual: Ácido Propiônico OH (origem: quase graxo) O H3C–CH2–CH2–C OH - 14 - IUPAC: Ácido Butanóico Usual: Ácido Butírico (origem: manteiga) Apostila de Química CMB IUPAC: Ácido Pentanóico Usual: Ácido Valérico (origem: raiz valeriana) O O Nomenclatura IUPAC IUPAC: Ácido Etanodióico Usual: Ácido Oxálico C–C HO Esta reação resulta em um sal orgânico e água. OH O –C OH H3C– IUPAC: Ácido Fenil-Metanóico Usual: Ácido Benzóico IUPAC: Ácido p-metil-benzóico Usual: Ácido p-toluil-benzóico –COOH No caso dos nomes IUPAC de ácidos que apresentam hidroxilas alcoólicas temos, além de ácido-álcool, funções mistas: ácido-cetona, ácidoamina, ácido-haleto orgânico, entre outras. A cadeia carbônica com o ácido carboxílico é classificada como principal, enquanto os demais grupos funcionais são considerados ramificações. Identifica-se o número de carbonos preso ao acilato, dando nomenclatura de hidrocarboneto seguido do prefixo -ATO. Se for necessário numerar, o Carbono 1 será o carbono do Acilato. Identifica-se o metal ou NH4+, colocando antes de seu nome o nome da parte do acilato e a preposição DE. Se o ânion do acilato for bivalente e dois cátions diferentes estiverem ligados a ele, antes da preposição DE utiliza-se a palavra DUPLO e entre o nome dos cátions coloca-se a conjunção E. Se o ânion do acilato for bivalente e apenas um cátion estiver ligado a ele, antes da preposição DE coloca-se a palavra ÁCIDO. Usual A nomenclatura usual dos sais é diferente da oficial apenas na parte do acilato. Assim como nos ésteres, o acilato recebe o nome usual do seu ácido de origem. Exemplos: O O Ácido 2-aminopropanóico ou Ácido -aminopropanóico CH3 – CH2 – C O-Na+ OH NH2 IUPAC: etanoato de sódio Usual: acetado de sódio H3 C – C O IUPAC: propanoato de potássio Usual: propionato de potássio H3C–CH2–C O Ácido 3-dibromoetanóico Br2CH – C O-K+ OH CH3 O CH3 – C – CH2 – C H3C–CH2–CH2–C Ácido 3-cetobutanóico metil-butanoato de amônio O-NH4+ OH O O OH O O Ácido 2-hidroxibenzóico –C OH Sais Orgânicos Os sais orgânicos são compostos originados da reação de uma base inorgânica com um ácido carboxílico O C–CH2– C Na+-O propanodiato ácido de sódio OH Portanto, utilizando anteriores, temos: um dos exemplos Ésteres O sabor e aroma artificiais dos alimentos são obtidos pela adição de substâncias classificadas como flavorizantes, que pertencem à função éster, em cujos compostos o hidrogênio da hidroxila é substituído por um grupo orgânico ou radical alquila ou arila. Profª Fátima Serrado - 15 - Apostila de Química O H3 C – C Substituindo o -H por –CH2CH3 CMB O Em casos que seja necessário numerar, o Carbono 1 é sempre o Carbono do Acilato. H3C – C O-CH2CH3 OH O O São compostos orgânicos que derivam dos ácidos carboxílicos por substituição do grupo hidroxila por halogênio. +X OH H3C–C – O – C–CH2–CH3 anidrido etanóico-propanóico O R–C CH3 anidrido-2-propanóico-2-metil-pentanóico Nomenclatura Usa-se a palavra cloreto, a preposição de e a seguir o prefixo + saturação + OILA. IUPAC: Cloreto de etanoíla Usual: Cloreto de acetila H3 C – C Cl O H3C – CH2– C Obtenção Os anidridos são preparados principalmente pela desidratação de ácidos em presença de agentes desidratantes como o P2O5, e pela reação entre um sal sódico de ácido e um cloreto de ácido: RCOOH + HOOCR RCO-O-OCR + H2O RCOONa + ClOCR RCO-O-OCR + NaCl IUPAC: Cloreto de propanoíla Usual: Cloreto de propionila Cl Anidridos de Ácidos São derivados dos ácidos carboxílicos, que resultam da desidratação dos ácidos. Apresentam a fórmula geral: O O Aminas A amônia (NH3), que é um composto inorgânico, dá origem a uma nova função orgânica, as aminas, pela substituição do átomo de hidrogênio por um, dois ou três hidrogênios por radicais alquila ou arila (aromáticos). Dessa forma, surge a classificação de amina primária, secundária e terciária. C–O– C R-O R’ O-R’ Obs.– Podemos substituir R e R’ por Ar– Nomenclatura O nome do anidrido é igual ao nome do ácido que lhe deu origem, precedido do termo anidrido. Quando o anidrido é formado por ácidos diferentes, devemos citar primeiro o nome do ácido de menor cadeia carbônica. R – NH2 R – NH Amina primária Amina secundária R’ R – N – R’’ Amina terciária Nomenclatura São citados os nomes dos grupos substituintes em ordem alfabética, seguidos da terminação amina. É similar à dos álcoois, substituindo-se o sufixo OL pela palavra AMINA, enquanto o nome usual é dado escrevendo-se os nomes dos grupos (metil, etil, fenil) ligados ao nitrogênio, seguidos da palavra amina. Antes do nome do Anidrido, coloca-se a palavra ANIDRIDO, para designar a função. Da-se o nome da menor parte do Anidrido do mesmo jeito que se daria a um Ácido, apenas retirando a palavra ÁCIDO do nome e depois da maior parte. Em Anidridos cujas partes são iguais, não é necessário repetir o nome. Profª Fátima Serrado O H3C–CH2–C – O – C–CH–CH2–CH2–CH3 X X = Cl, Br, I O O O – OH R–C IUPAC: anidrido etanóico Usual: anidrido acético H3C – C – O – C– CH3 Haletos de Ácidos O O CH3 – NH2 IUPAC: metanamina Usual: metilamina CH3 – CH2 – NH2 IUPAC: etanamina Usual: etilamina - 16 - Apostila de Química CMB CH3 – CH2 – NH – CH2 – CH3 As amidas classificam-se em primárias, secundárias e terciárias, dependendo do número de substituintes do átomo de azoto. CH3 IUPAC:N-etil-N-metilpropanamina Usual: metiletilpropilamina As aminas aromáticas nas quais o nitrogênio se liga diretamente ao anel benzênico Ar–NH2 são, geralmente, nomeadas como se fossem derivadas da amina aromática mais simples: a amina (fenilamina). – NH2 Fenilamina Fenil-metilamina – NH – CH3 N-metilamina-benzeno N-metilamilina Para aminas mais complexas, consideramos o grupo NH2 como sendo uma ramificação, chamada de amino. CH3 CH3 Nomenclatura As amidas primárias designam-se substituindo o sufixo -oico do nome do ácido carboxílico pela terminação -amida. As amidas substituídas designamse antepondo um N ao nome dos substituintes. Exemplos: CH3 – C – CH – CH – CH2 – CH3 NH2 2-amino-4-fenil-2,3-dimetilhexano NH2 NH2 1,4-diamino-benzeno p-diamino-benzeno Amidas As amidas são compostos orgânicos que se formam por reação de um ácido carboxílico com o amoníaco ou uma amina. Podem ser consideradas como derivadas do NH3 pela substituição de um, dois ou três hidrogênios pelos radicais acila: Profª Fátima Serrado Vemos, freqüentemente, a palavra poliamida escrita nas etiquetas de roupas de laicra, isto é, aquelas que esticam. Isso está relacionado com amidas. Também nas proteínas, a ligação peptídica ocorre com formação de uma amida. - 17 - Apostila de Química CMB nomenclatura é obtida colocando-se a palavra NITRO anteriormente ao nome do hidrocarboneto correspondente. Podem se considerados como derivados do ácido nítrico: Nitrilas Apresentam o grupo funcional ou · O próprio HCN pode ser considerado uma nitrila. As nitrilas são compostos derivados do cianeto de hidrogênio, HCN, pela substituição do hidrogênio por um grupo orgânico (metil, etil, etc). pela substituição do –OH por um radical alquil ou aril; por isso, tem fórmula geral ou Nomenclatura IUPAC É dado nome ao hidrocarboneto correspondente seguido da terminação nitrila. O grupo funcional é o grupo Nitro ou Nomenclatura usual Usa-se a palavra cianeto e, em seguida, o nome do radical preso ao grupo – CN. IUPAC: metanonitrila Usual: cianeto de metila – NO2 Nomenclatura IUPAC: Usa-se prefixo nitro antecedendo o nome do hidrocarboneto de que se origina o nitro composto. Exemplo IUPAC: etanonitrila Usual: cianeto de etila H3C – NO2 nitrometano IUPAC: propanonitrila Usual: cianeto de propila CN IUPAC: benzononitrila Usual: cianeto de fenila 2-nitropentano A nitrila mais importante é o propenonitrila (acrilonitrila). sonitrilas Isonitrilas ou isocianetos contendo o grupo funcional: são compostos 2,4,6-trinitrotolueno (TNT) Elas derivam do ácido isocianídrico HNC. Isonitrila ou isocianeto de metila Nitrocompostos Nitrocompostos são compostos obtidos pela substituição da hidroxila do ácido nítrico HNO3 ou HO–NO2 por um grupo orgânico (metil, etil, etc.). A Profª Fátima Serrado 2,4,6-trinitrofenol - 18 - Apostila de Química CMB + Sal Orgânico: M = metal ou amônio, NH4 . Reconhecimento das Funções Orgânicas FUNÇÕES ORGÂNICAS OXIGENADAS Álcool: Hidroxila ligada a carbono saturado. FUNÇÕES ORGÂNICAS NITROGENADAS Aminas: São bases orgânicas obtidas pela substituição dos Se o oxigênio da hidroxila for substituído pelo enxofre, teremos um tio-álcool. hidrogênios da amônia por cadeias carbônicas. Éter: Átomo de oxigênio entre átomos de carbono. Se o oxigênio for substituído pelo enxofre, teremos um tioéter. Amida: Apresenta nitrogênio ligado diretamente a carbonila. Fenol: Hidroxila liga a anel benzênico. Nitrila: Apresenta nitrogênio ligado a carbono por ligação tripla. Aldeído: Carbonila liga a hidrogênio. Ácido Carboxílico: Carbonila liga a hidroxila. Recebe o nome de carboxila. Cetona: Carbonila entre carbonos. Éster: Heteroátomo entre carbonos e ligado diretamente a uma carbonila. Anidrido: Heteroátomo entre carbonos e ligado diretamente a duas carbonilas. Profª Fátima Serrado - 19 -
Download