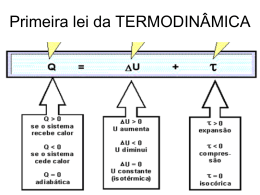
Sumário do Volume Física Fenômenos Térmicos – Termodinâmica 5 1. Primeira lei da termodinâmica 1.1 O gás também realiza trabalho 1.2 Quanto vale a energia de um gás? 2. Segunda lei da Termodinâmica 2.1 Entendendo as máquinas térmicas e as máquinas frigoríficas 5 5 7 17 17 Fenômenos Eletrostáticos 24 3. Conhecendo a eletrostática 4. A força entre dois corpos carregados 5. A Terra cria o campo gravitacional. E a carga cria campo? 5.1 O campo elétrico também pode ser uniforme 6. O potencial elétrico que as cargas criam 6.1 Os corpos carregados também realizam trabalho 7. Condutores em equilíbrio eletrostático 7.1 O poder das pontas 7.2 Capacitância dos corpos 8. Capacitores 8.1 Capacitância de um capacitor plano 8.2 Associação de capacitores 26 39 45 48 55 60 69 71 74 80 81 84 Fenômenos Eletrodinâmicos – I 90 9. O que faz a gente tomar choque? 10. A resistência que os aparelhos impõem a passagem da corrente elétrica 10.1 Leis de Ohm 10.2 Associando as resistências 11. Como fazemos medidas em um circuito elétrico? 11.1 Medidor de corrente 11.2 Medidor de voltagem 11.3 Medidor de resistência 92 97 97 102 109 109 109 112 Sumário Completo VOLUME 1 Unidade: Fenômenos Térmicos – Termodinâmica 1. Primeira lei da termodinâmica 2. Segunda lei da termodinâmica Unidade: Fenômenos Eletrostáticos 3. Conhecendo a eletrostática 4. A força entre dois corpos carregados 5. A Terra cria o campo gravitacional. E a carga cria campo? 6. O potencial elétrico que as cargas criam 7. Condutores em equilíbrio eletrostático 8. Capacitores Unidade: Fenômenos Eletrodinâmicos – I 9. O que faz a gente tomar choque? 10. A resistência que os aparelhos impõem à passagem da corrente elétrica 11. Como fazemos medidas em um circuito elétrico? VOLUME 2 Unidade: Fenômenos Eletrodinâmicos – II 12. Quanto de energia um aparelho pode gastar? 13. O que se faz aparecer a corrente em um circuito elétrico? 14. Aparelhos que funcionam devido à energia elétrica 15. Leis de Kirchhoff Unidade: Fenômenos Eletromagnéticos – I 16. Ímã 17. Campo magnético criado por correntes elétricas VOLUME 3 Unidade: Fenômenos Eletromagnéticos – II 18. Força magnética em cargas elétricas 19. Indução eletromagnética 20. Transformadores Unidade: Fenômenos Modernos 21. Introdução aos fenômenos quânticos 22. A Física nos modelos atômicos 23. Introdução à teoria da Relatividade 5 Física Primeira lei da termodinâmica FeNÔmeNos tÉrmicos – termodiNÂmica 1. primeira lei da termodiNÂmica Termodinâmica é o nome dado à parte da ciência http://www.4lots.com – acessado em 01/07/2008 que estuda as relações entre calor, energia, trabalho e as variáveis de estado de um sistema que passa por transformações. A princípio, essas mudanças podem parecer complexas e indecifráveis, mas, na verdade, estão baseadas em algumas definições simples e em conceitos que já foram trabalhados anteriormente. estiver dentro dele pertencem ao sistema. Todo o resto é chamado de meio externo e não pertence ao sistema. Em geral, o sistema considerado é um gás que passa por transformações. • Sistema aberto: considera-se um sistema aberto quando existe de troca de energia e/ou de massa entre o sistema e sua vizinhança (meio externo), como, por exemplo, a queima de uma brasa de carvão. • Sistema isolado: ao contrário do sistema aberto, um sistema isolado é aquele que não permite troca de energia e massa entre seus constituintes e a vizinhança do sistema. • Ciclo: conjunto de transformações sofridas pelo sistema no qual o estado final e o inicial do sistema apresentam as mesmas características, ou seja, são estados idênticos. • Trabalho externo: é uma forma de transferência de energia entre o sistema e o meio externo. No caso de sistemas termodinâmicos, o trabalho está sempre relacionado a uma mudança de volume do gás analisado. 1.1 O gás também realiza trabalho Imaginemos um cilindro circular oco, contendo Um pneu sendo cheio é objeto de estudo da Termodinâmica. Por exemplo, se uma certa quantidade de gás é aquecida e estiver em um recipiente com pelo menos uma parede móvel, é bem provável que o volume desse gás aumente. Esse aumento de volume está relacionado a um trabalho realizado, que, por sua vez, está diretamente ligado à quantidade de calor recebida pelo gás. A Termodinâmica é a parte da Física que torna possível entender como esses processos ocorrem e a relação entre eles. Para tal entendimento, é necessário conhecer alguns conceitos relacionados aos sistemas que serão estudados. • Sistema: conjunto de elementos ou objetos que serão temas de estudo. Por exemplo, se serão estudadas as transformações ocorridas em um balão de aniversário, somente o balão e o que um certo volume V0 de gás dentro dele. Esse cilindro tem paredes rígidas e sua tampa é composta por um êmbolo móvel. Esse tipo de cilindro é capaz de manter a pressão do gás que está em seu interior sempre igual à pressão externa. Se esse sistema receber calor e por isso sofrer um aumento de temperatura, o seu volume irá variar, movendo o êmbolo. O esquema de um corte axial desse cilindro está na figura a seguir: P0 P0 ∆h P0, V0 e T0 P0, Vf e TF 6 Física Primeira lei da termodinâmica Em Mecânica, o trabalho realizado ou recebido está relacionado à ação de uma força durante uma certa distância. O produto da distância percorrida e da força utilizada pode ser entendido como o trabalho realizado a cada ponto. Matematicamente, tem-se: τ = F . d. Nesse caso, a distância percorrida pelo êmbolo foi ∆h, e a força que realizou trabalho no gás foi devido a sua pressão. Com isso, temos que: P = F ⇒ F = P . A, A em que P é a pressão do gás, A é a área da seção reta do cilindro e F é a força que realiza o trabalho. Considera-se que a dilatação do cilindro é desprezível, fazendo com que a sua área de seção reta seja a mesma nos dois estados. Utilizando-se essa relação com a equação do trabalho, tem-se que: τ = P . A . ∆h , em que A . ∆h = ∆V é variação do volume do gás. Sendo assim: τ = P . ∆V ou τ = P (Vf – V0), em que (Vf – V0) é a diferença entre o volume do gás no estado f (final) e no estado 0 (inicial). Isso quer dizer que o trabalho em uma transformação isobárica é dado pelo produto da pressão do gás e da variação de volume sofrida por ele, devido ao seu aquecimento. Convenção de sinais Se durante a transformação ocorrer aumento do volume do gás, ou seja, o volume final (Vf ) for maior que o volume inicial (V0), o trabalho será positivo, já que a pressão só admite valores positivos. Nesse caso, diz-se que o trabalho foi realizado pelo sistema, ou seja, o gás realiza trabalho sobre o meio exterior. No caso inverso, onde ocorrer diminuição do volume do gás, ou seja, se seu volume final (Vf ) for menor que o volume inicial, o trabalho será negativo. Nesse caso, diz-se que o trabalho foi realizado sobre o sistema, ou seja, o meio exterior realiza trabalho sobre o sistema. Sistematizando: • Vf > V0 → ∆V > 0 → τ > 0 → trabalho realizado pelo o sistema. • Vf < V0 → ∆V < 0 → τ < 0 → trabalho realizado sobre o sistema. • Vf = V0 → ∆V = 0 → τ = 0 → trabalho nulo. A seguir, pode ser visto o gráfico da pressão pelo volume de um gás que sofre uma transformação isobárica: P P0 0 f V0 V1 V Gráfico de uma transformação isobárica. No gráfico, é possível visualizar que o produto da pressão pela variação do volume do gás indica exatamente a área abaixo da curva e entre os dois valores de volume analisados. Isso quer dizer que, numericamente, o trabalho realizado ou recebido pelo gás é dado pela área abaixo da curva no gráfico da pressão pelo volume. Numericamente, pode ser escrito: N Acurva = τtotal Essa análise foi feita para o caso de uma transformação isobárica. Entretanto, a análise do gráfico P x V (pressão por volume) será importante também para as outras transformações. Trabalho em uma transformação qualquer Para qualquer mudança ocorrida entre dois estados de um sistema termodinâmico, é possível fazer um gráfico da pressão pelo volume do gás que passa por essa transformação. P VA VB V P VA VB V Gráficos de pressão por volume em transformações onde a pressão não é constante. 7 Física Primeira lei da termodinâmica No caso de transformações onde a pressão do gás não é constante, fica muito mais complicado fazer o cálculo do trabalho realizado pelo gás ou sobre o gás. No entanto, viu-se que, em uma transformação isobárica, o trabalho era numericamente igual à área abaixo da curva no gráfico P x V dessa transformação. Pode-se provar que, também no caso de uma transformação qualquer, o trabalho realizado pelo sistema ou sobre ele pode ser dado pela área abaixo da curva que essa transformação descreve em um gráfico P x V. Com isso, pode ser escrito: τ VA VB V Mesmo nesses casos, é possível perceber que o trabalho é numericamente igual à área descrita dentro das curvas da transformação cíclica do gás. 1.2 Quanto vale a energia de um gás? N τ= Acurva indicando que o trabalho é numericamente igual à área abaixo da curva no gráfico P x V de uma transformação qualquer. A convenção de sinais adotada para o trabalho de uma transformação isobárica pode ser generalizada para o trabalho realizado em uma transformação qualquer. Além disso, é interessante ressaltar que o trabalho realizado em qualquer transformação termodinâmica não depende somente dos estados inicial e final do sistema, mas também de todos os seus estados intermediários. Desde que seja mantida a convenção de sinais, em uma transformação cíclica, o trabalho será dado pela soma algébrica dos trabalhos realizados em cada uma das transformações do sistema. Observe os gráficos: P τ VB VA V P τ VA P VB V C omo adiantado anteriormente, a energia interna de um gás ideal é dada pela soma da energia cinética média de todas as moléculas que compõem o gás. Dessa forma, a energia interna de um gás (U) pode ser dada da seguinte forma: U = NEcin ⇒ U = 3 nRT. 2 Vê-se que a energia interna de uma massa de gás ideal depende somente da quantidade de moléculas presentes no gás e de sua temperatura. No entanto, ela pode ser escrita de outra forma, de acordo com a equação de Clapeyron: U = 3 nRT ⇒ U = 3 PV, 2 2 ou seja, pode ser dada também em termos do produto da pressão pelo volume do gás. Anote e note: A energia interna dos gases ideais está diretamente relacionada à sua temperatura. Se a temperatura do gás aumenta, a energia interna aumenta. Se sua temperatura diminui, a energia interna do gás irá diminuir. No caso de não haver mudança de temperatura do gás, sua energia interna permanece constante. Todos os desenvolvimentos anteriores foram feitos para gases ideais monoatômicos. No entanto, para gases diatômicos ou poliatômicos, irá valer a relação U > 3 nRT e seu cálculo exato fica bastante 2 complicado. 8 Física Primeira lei da termodinâmica Exercícios de sala 1 (UFMS) Sem variar sua massa, um gás ideal sofre uma transformação a volume constante. É correto afirmar que: a) a transformação é isotérmica. b) a transformação é isobárica. c) o gás não realiza trabalho. d) sua pressão diminuirá, se a temperatura do gás aumentar. e) a variação de temperatura do gás será a mesma em qualquer escala termométrica. 2 Numa expansão isobárica (pressão constante), o trabalho realizado por um gás é tanto maior quanto: a) maior a pressão e maior a variação de volume. b) menor a pressão e maior a variação de volume. c) maior a pressão e maior o volume. d) menor a pressão e menor o volume. e) maior a pressão e menor o volume. 3 (PUC-SP) O gráfico pressão (p) X volume (V) representa as transformações AB e BC experimentadas por um gás ideal: 1 B Dado que não ocorre nenhuma reação química entre as moléculas que compõem o gás, nessa transição de 1 para 2 podemos afirmar que: a) o meio externo realizou um trabalho sobre o gás, e a temperatura do gás aumentou. b) o gás realizou um trabalho para o meio externo, que é numericamente igual à região hachurada do diagrama PV, e a energia cinética média das partículas que compõem o gás diminuiu. c) o gás realizou um trabalho para o meio externo, que é numericamente igual à região hachurada do diagrama PV, e a energia cinética média das partículas que compõem o gás aumentou. d) o gás realizou um trabalho para o meio externo, que é numericamente igual à região hachurada do diagrama PV, e a energia cinética média das partículas que compõem o gás diminuiu no mesmo valor do trabalho realizado. C 20 10 A 0 1 3 2 V P (N/m2) 30 P 2 1 5 (UNITAU-SP) Um gás está confinado num cilindro provido de um pistão. O gás é então aquecido, e o pistão é mantido fixo na posição inicial. Qual é a alternativa errada? a) A pressão do gás aumenta. b) O trabalho realizado pelo gás é cada vez maior. c) A força que o gás exerce no pistão é cada vez maior. d) O gás é mantido num volume constante. e) A energia interna do gás é cada vez maior. 6 (PUC-SP) Uma amostra de gás ideal sofre o processo termodinâmico cíclico representado no gráfico a seguir: V (m3) Qual o trabalho mecânico realizado pelo gás durante a expansão de A até C? Dê a resposta em joules. P (N/m2) 4 (UFU) Um gás bastante rarefeito está contido num balão de volume variável e é feito de um material que permite trocas de calor com o meio externo (paredes diatérmicas). Esse gás sofre uma transição, passando de sua configuração (inicial) 1 para uma segunda configuração (final) 2, conforme o diagrama PV apresentado a seguir. 30 10 0,1 0,3 V(m3) 9 Física Primeira lei da termodinâmica Ao completar um ciclo, o trabalho, em joules, realizado pela força que o gás exerce nas paredes do recipiente é: a) + 6. b) + 4. c) + 2. d) – 4. e) – 6. a) b) c) d) e) 9 7 (PUC-MG) A transformação cíclica representada no diagrama a seguir mostra o que ocorreu com uma massa de gás perfeito. B 2P0 2 A P0 5 10 15 20 V () Qual o trabalho realizado por esse gás em cada ciclo? Dê a resposta em joules. 8 (UERJ) Uma certa quantidade de gás oxigênio submetida a baixas pressões e altas temperaturas, de tal forma que o gás possa ser considerado ideal, sofre uma transformação A → B, conforme mostra o diagrama pressão x volume. P p (105 N/m2) 4 0 5,0. 2,4. 1,8. 1,6. 1,0. (UFTM) Em uma máquina, o gás contido no interior de um êmbolo obedece ao diagrama esquematizado. 0 V0 2V0 3V0 V a) Calcule o módulo do trabalho realizado sobre o gás, nessa transformação. b) Esboce o diagrama pressão x temperatura absoluta (P x T), assinalando os estados A e B. pressão (x 105 Pa) 3,0 2,5 2,0 1,0 0 2,0 3,0 4,0 6,0 volume (x 10−6 m3) O trabalho realizado por esse gás, em sua fase de expansão dentro do cilindro, é, em J, aproximadamente: 10 (UFRRJ) Certa massa gasosa, contida num reservatório, sofre uma transformação termodinâmica no trecho AB. O gráfico mostra o comportamento da pressão P, em função do volume V. 10 Física Primeira lei da termodinâmica c) Qual é a temperatura adquirida pelo gás no estado C? Dado: R(constante dos gases) = 0,082 atm ∙ /mol K = 8,3J/mol K. P (x104N/m2) A 30 B 10 20 40 V (x10-2m3) O módulo do trabalho realizado pelo gás, na transformação do trecho AB, é de: a) 400 J. b) 800 J. c) 40 kJ. d) 80 kJ. e) 600 J. 11 (UNICAMP) Um mol de gás ideal sofre a transformação A → B → C indicada no diagrama pressão x volume da figura a seguir. p (atm) 3,0 A B isoterma 8,0 C 10,0 V () 12 (ENEM) Considere as afirmações: I) Calor e trabalho são formas de transferência de energia entre corpos. II) Calor é medido necessariamente em calorias, enquanto trabalho é somente medido em joules. III) Dez calorias valem aproximadamente 42 joules. a) b) c) d) e) Pode-se afirmar que apenas: I é correta. II é correta. III é correta. I e II são corretas. I e III são corretas. 13 (UFPE) Um mol de um gás ideal, inicialmente à temperatura de 300 K, é submetido ao processo termodinâmico A → B → C mostrado no diagrama V ‘versus’ T. Determine o trabalho realizado pelo gás, em calorias. Considere R = 2,0 cal/mol.K. V (m3) 0,3 B C 900 1 200 a) Qual é a temperatura do gás no estado A? 0,1 0 b) Qual é o trabalho realizado pelo gás na expansão A → B? a) b) c) d) e) A 300 600 T (K) 1 200 cal 1 300 cal 1 400 cal 1 500 cal 1 600 cal Exercícios propostos 14 (FATEC-SP) Um sistema termodinâmico, constituído de certa massa de gás perfeito, realiza a cada segundo 100 ciclos ABCDA. O diagrama a seguir mostra a evolução de um ciclo ABCDA. Física Primeira lei da termodinâmica p (105 Pa) 2,0 B 1,0 C A 0 D 1,0 2,0 3,0 V (cm3) Qual a potência desse sistema? Dê a resposta na unidade Watt. 15 (UFRGS) Uma amostra de gás ideal, quando submetida à pressão PA = 100 kPa, ocupa o volume VA = 25 . O ponto A do diagrama P x V a seguir representa esse estado. A partir do ponto A, a amostra sofre três transformações termodinâmicas e completa o ciclo que aparece no diagrama. Q = τ + ∆U P(kPa) B 200 100 A 25 C V () 50 Qual é o trabalho líquido realizado pelo gás no ciclo completo? a) 1,25 J. d) 2,50 . 103 J. b) 2,50 J. e) 2,50 . 106 J. 3 c) 1,25 . 10 J. 16 (UFC) Um gás ideal sofre as transformações mostradas no diagrama da figura a seguir. p p2 p1 Existe na natureza o chamado princípio da conservação da energia. De acordo com ele, nenhum tipo de energia pode ser criado ou destruído na natureza. Na verdade, a única possibilidade é a transformação de um tipo de energia em outro. Dessa forma, imaginemos um gás que recebe 200 J de calor e, com isso, realiza um trabalho cujo valor é de 60 J. Onde foi parar o resto da energia? De acordo com a primeira lei da Termodinâmica, o restante da energia foi incorporado à energia interna do sistema. Isso quer dizer que, se um sistema recebe 200 J de calor e, por isso, realiza um trabalho de 60 J, os 140 J restantes são creditados à variação de energia interna do sistema. Matematicamente, teremos: B C A V0 2V0 D 5V0 6V0 V Determine o trabalho total realizado durante os quatro processos termodinâmicos A → B → C → D → A. A Primeira lei da Termodinâmica A discussão sobre a energia interna de um sistema é importante, mas a variação dessa energia interna é ainda mais. Isso porque essa variação terá como reflexo uma mudança de temperatura do gás e, além disso, é importante relacionar os conceitos de fluxo de calor e trabalho com a variação da energia interna de um sistema. em que Q é o calor recebido ou cedido pelo sistema, τ é o trabalho realizado pelo sistema ou sobre ele e ∆U é a variação da sua energia interna. Na verdade, a primeira lei da Termodinâmica é uma versão específica do princípio da conservação de energia. Convenção de sinais Calor • Se o gás recebe calor → Q > 0. • Se o gás cede calor → Q < 0. • Se não há troca de calor → Q = 0 → Transformação adiabática Trabalho • Se o gás realiza trabalho sobre o sistema → τ > 0. • Se o trabalho é realizado sobre o gás → τ < 0. • Se não há trabalho realizado → τ = 0 → Volume constante. Energia Interna • Se há aumento da energia interna → ∆U > 0 → há aumento de temperatura. • Se há diminuição da energia interna → ∆U < 0 → há diminuição da temperatura. • Se não há variação da energia interna → ∆U = 0 → A transformação é isotérmica. 11 12 Física Primeira lei da termodinâmica Primeira lei aplicada às transformações gasosas • Transformação isotérmica: Numa transformação isotérmica, mesmo que um gás receba calor, esse calor não causa um aumento de temperatura. Dessa forma, a variação da energia interna do sistema é nula e, de acordo com a 1a lei: Q = τ + ∆U, mas ∆U = 0, então: Q = τ. Ou seja, em uma transformação isotérmica, todo calor é transformado em trabalho ou vice-versa. • Transformação isobárica: Quando a pressão do gás permanece constante durante a transformação, o volume e a temperatura de um gás ideal ficam relacionados de forma direta. Isso que dizer que se um deles aumenta, o outro também. Dessa forma, se há aumento da energia interna do gás, haverá aumento de temperatura e, consequentemente, de volume. Isso faz com que o trabalho também seja positivo, mas nenhum termo da primeira lei irá se anular e ela continuará sendo Q = τ + ∆U. • Transformação isocórica: Em uma transformação isocórica, o volume não varia. Isso quer dizer que o trabalho realizado pelo sistema ou sobre ele é nulo τ = 0. Assim, a primeira lei fica: Q = ∆U, ou seja, todo fluxo de calor resulta em um aumento ou em uma diminuição da energia interna. Anote e note: Relação da Mayer: É possível provar que existe uma relação bastante estreita entre o calor molar de um gás a volume constante (CV) e o calor molar a pressão constante (CP). Essa relação é dada por: CP – CV = R, onde R é a constante universal dos gases perfeitos. • Transformação adiabática: Adiabática é uma expressão que significa “sem troca de calor”. A ideia de uma transformação adiabática é exatamente essa, uma transformação na qual a pressão e a temperatura do gás mudem, mas ele não troque calor com o meio externo. De acordo com a 1a lei, isso seria interpretado da seguinte forma: se Q = 0, então 0 = τ + ∆U ⇒ ∆U = – τ. Isso indica que todo trabalho realizado em uma transformação adiabática resulta em uma variação da energia interna. No entanto, se o trabalho é realizado pelo sistema (τ > 0), a variação da energia interna será negativa e vice-versa. A seguir, pode ser visto o comportamento de cada uma das transformações apresentadas anteriormente descritas pelo gráfico de pressão por volume (P x V). P isobárica isocórica isotérmica adiabática V Nesses gráficos, é possível observar uma transformação isotérmica (linha azul), uma transformação isobárica (linha vermelha) e uma transformação adiabática (linha verde). Como o trabalho é nulo em uma transformação isocórica, ele é representado no gráfico P x V por uma linha vertical (amarela). Exercícios de sala 17 A 1a Lei da Termodinâmica, aplicada a uma transformação gasosa, se refere à: a) conservação de massa do gás. b) conservação da quantidade de movimento das partículas do gás. c) relatividade do movimento de partículas subatômicas, que constituem uma massa de gás. d) conservação da energia total. e) expansão e contração do binômio espaçotempo no movimento das partículas do gás. 18 (UFV-MG) A Primeira Lei da Termodinâmica relaciona os seguintes parâmetros relativos a um sistema em interação com sua vizinhança: variação da energia interna (∆U), trabalho realizado (τ) e calor trocado (Q). Com base nessa lei, pode-se afirmar que, nas transformações I, II e III de um gás ideal, representadas a seguir, as relações corretas são, respectivamente: (I) 10 ºC (II) 20 ºC paredes condutoras 10 ºC (III) 10 ºC paredes condutoras 10 ºC 5 ºC paredes adiabáticas a) ∆U = τ τ=Q ∆U = Q b) ∆U = Q ∆U = τ Q=τ c) ∆U = Q τ=Q ∆U = – τ d) Q=0 τ=Q ∆U = 0 e) Q=τ τ=Q ∆U = τ 13 Física Primeira lei da termodinâmica 19 (ENEM) Um sistema termodinâmico cede 200 J de calor ao ambiente, enquanto sobre o sistema se realiza trabalho de 300 J. Nessas condições, a variação de sua energia interna é, em joules, de: a) – 500. c) 100. e) 500. b) – 100. d) 250. c) a pressão do gás aumenta e o aumento da sua energia interna é igual ao calor fornecido. d) a pressão do gás permanece constante e o aumento da sua energia interna é menor que o calor fornecido. 22 (UFU) Num dado recipiente contendo um líquido, é imerso um cilindro contendo gás ideal, confinado por um êmbolo móvel, conforme as figuras adiante. êmbolo móvel cilindro gás 20 (UFSM) A figura representa, no diagrama P x V, a expansão isotérmica que um mol de gás ideal sofre, ao receber 1 728 J de energia na forma de calor. O trabalho realizado na expansão de 1 m3 para 2 m3 é, em J: P(N/m2) 2 493 1 246,5 0 a) 0 b) 270 300 k 1 c) 870 v(m3) 2 d) 1 728 e) 1 870 recipiente líquido fonte térmica Q= 2 000 J (I) (II) O recipiente está sobre uma fonte térmica e a base do recipiente é diatérmica, permitindo trocas de calor entre a fonte e o recipiente. As demais paredes do recipiente são adiabáticas e as paredes do cilindro que contém o gás são diatérmicas. A fonte térmica fornece 2 000 J para o sistema formado pelo líquido e o gás, conforme figura (I) anterior. Devido ao calor fornecido pela fonte térmica, a temperatura do líquido aumenta de 3 K, consumindo 1 500 J. Por outro lado, o gás realiza uma expansão com um aumento de volume de 8 m3, a uma pressão constante de 50 N/m2, como representando na figura (II) anterior. a) Calcule o trabalho realizado pelo gás. 21 (UFMG) Um cilindro é fechado por um êmbolo que pode se mover livremente. Um gás, contido nesse cilindro, está sendo aquecido, como representado nesta figura: b) Calcule a variação da energia interna do gás. êmbolo gás Com base nessas informações, é correto afirmar que, nesse processo: a) a pressão do gás aumenta e o aumento da sua energia interna é menor que o calor fornecido. b) a pressão do gás permanece constante e o aumento da sua energia interna é igual ao calor fornecido. c) Nesse processo, o que acontece com a energia cinética das partículas que compõem o gás: aumenta, diminui ou não muda? Justifique. 14 Física Primeira lei da termodinâmica 23 (UNESP) Um mol de gás monoatômico, classificado como ideal, inicialmente à temperatura de 60 ºC, sofre uma expansão adiabática, com realização de trabalho de 249 J. Se o valor da constante dos gases R é 8,3 J / (molL) e a energia interna de um mol desse gás é (3/2)RT, calcule o valor da temperatura ao final da expansão. P I II III V1 a) II, III e I. b) III, II e I. 24 (UNESP) Um gás ideal, confinado no interior de um pistão com êmbolo móvel, é submetido a uma transformação na qual seu volume é reduzido à quarta parte de seu volume inicial, em um intervalo de tempo muito curto. Tratando-se de uma transformação muito rápida, não há tempo para trocar de calor entre o gás e o meio exterior. Pode-se afirmar que a transformação é: a) isobárica, e a temperatura final do gás é maior que a inicial. b) isotérmica, e a pressão final do gás é maior que a inicial. c) adiabática, e a temperatura final do gás é maior que a inicial. d) isobárica, e a energia interna final do gás é menor que a inicial. e) adiabática, e a energia interna final do gás é menor que a inicial. 25 (PUC-RS) Uma certa quantidade de ar contido num cilindro com pistão é comprimida adiabaticamente, realizando-se um trabalho de – 1,5 kJ. Portanto, os valores do calor trocado com o meio externo e da variação de energia interna do ar nessa compressão adiabática são, respectivamente: a) – 1,5 kJ e 1,5 kJ. b) 0,0 kJ e – 1,5 kJ. c) 0,0 kJ e 1,5 kJ. d) 1,5 kJ e – 1,5 kJ. e) 1,5 kJ e 0,0 kJ. V2 c) I, II e III. d) II, I e III. V e) I, III e II. 27 (UEL) Em relação às transformações de um gás ideal é correto afirmar: ( ) Numa expansão isobárica, a quantidade de calor recebida é maior que o trabalho realizado. ( ) Numa transformação isocórica, a variação da energia interna do gás é maior que a quantidade de calor trocada com o meio exterior. ( ) Numa transformação adiabática, a variação da energia interna é igual ao trabalho realizado. ( ) Numa transformação isocórica, a variação da energia interna do gás é menor que a quantidade de calor trocada com o meio exterior. 28 (UFMG) Em uma transformação isobárica de um gás perfeito, mantido a 2,0 . 105 N/m2 de pressão, forneceram-se 1 500 J de calor e provocou-se um aumento de volume de 3,0 litros. Em joules, qual foi a variação da energia interna do gás? 29 (UFPE) No ciclo mostrado no diagrama PV da figura a seguir, a transformação AB é isobárica, BC é isovolumétrica e CA é adiabática. Sabese que o trabalho realizado sobre o gás na compressão adiabática é igual a WCA = – 150 J. Determine a quantidade de calor total Q(tot) absorvido pelo gás durante um ciclo, em joules. P (105 N\m2) 3,0 A B C 0,2 26 (UFSM-RS) A figura representa os processos isotérmico, adiabático e isobárico para gases ideais, entre estados com volumes V1 e V2. Esses processos estão indicados, na figura, respectivamente por: 1,0 V (10-3m3) 15 Física Primeira lei da termodinâmica Exercícios propostos 30 (UNIFESP) A figura representa uma amostra de um gás, suposto ideal, contida dentro de um cilindro. As paredes laterais e o êmbolo são adiabáticos; a base é diatérmica e está apoiada em uma fonte de calor. cilindro êmbolo Pela análise das afirmações, conclui-se que somente: a) está correta a I. b) está correta a II. c) está correta a III. d) estão corretas a I e a III. e) estão corretas a II e a IV. 33 (PUC-MG) Uma bomba de encher bolas é acionada rapidamente com o orifício de saída do ar vedado, comprimindo-se o ar em seu interior, que vai do estado inicial 1 para o estado final 2. gás AR ESTADO 1 fonte de calor Considere duas situações: I) O êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante. II) O êmbolo é fixo, mantendo o gás a volume constante. Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar: a) igualmente em ambas as situações. b) mais em I do que em II. c) mais em II do que em I. d) em I, mas se mantém constante em II. e) em II, mas se mantém constante em I. 31 (MACK-SP) Uma amostra de gás perfeito sofre uma transformação isobárica sob pressão de 60 N/m2, como ilustra o diagrama. Admita que, na transformação, o gás recebe uma quantidade de calor igual a 300 J. V (m3) Q 3 1 P 0 100 ESTADO 2 AR Nessas condições, é correto afirmar que a transformação termodinâmica, observada na passagem do estado 1 para o estado 2, aproxima-se mais de: a) uma isométrica, já que a quantidade de gás se mantém constante. b) uma adiabática, porque não há trocas de calor do ar com a vizinhança. c) uma isotérmica, porque a temperatura do ar não se altera. d) uma isobárica, porque a pressão não se altera. 34 (UFF) O gráfico representa a transformação de um gás ideal que passa do estado I para o estado II e, depois, do estado II para o estado III. Para que o gás passe do estado I para o II, é necessário que se lhe forneçam 100 kJ de calor; para que passe do estado II para o III, que se lhe retirem 50 kJ de calor. Sabe-se que a pressão do gás no estado I é de 100 kPa. V (m3) 300 T (K) Qual foi a variação da energia interna do gás? 32 (PUC-RS) Responder à questão com base nas afirmações a seguir. I) A energia trocada entre dois sistemas, unicamente devida à diferença de temperatura entre ambos, chama-se calor. II) Na transformação adiabática de um gás, sua energia interna permanece constante. III) A energia interna de um sistema não depende do número de partículas que o constituem. IV) A temperatura absoluta de um sistema depende do número de partículas que o constituem. 12 10 III II I 100 120 T (K) Pode-se afirmar que a variação da energia interna do gás ao passar do estado I para o III é igual a: a) zero d) – 140 kJ b) – 200 kJ e) – 150 kJ c) – 50 kJ Prezado leitor, Agradecemos o interesse em nosso material. Entretanto, essa é somente uma amostra gratuita. Caso haja interesse, todos os materiais do Sistema de Ensino CNEC estão disponíveis para aquisição através de nossa loja virtual. loja.cneceduca.com.br
Download