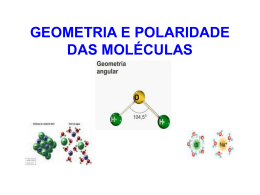
2. QUÍMICA GERAL Química é a ciência que trata das substâncias da natureza, dos elementos que a constituem, de suas características, de suas propriedades combinatórias, de processos de obtenção, de su as aplicações e de sua identificação. Descreve de qual maneira os elementos se juntam e reagem entre si, bem como, a energia desprendida ou absorvida durante estes transformações. A química é o estudo das transformações da matéria em oposição à física que é o estudo de seus estados. 2.1 Conceitos Básicos Matéria - é tudo o que tem massa e ocupa lugar no espaço. A matéria inclui os materiais que formam o Universo: as rochas, a água, o ar e a multiplicidade de coisas vivas. Tudo que é sólido, liquido ou gasoso é uma forma de matéria. Os estados físicos da matéria são definidos pelo grau de mobilidade interno e a compactação dos átomos, moléculas e elétrons Tabela: Estados físicos (fases) da matéria Propriedade Estado Físico Forma Volume Compressibilidade Sólido definida definido extremamente baixa Líquido Variável (depende do recipiente) definido baixa Gasoso variável variável alta Átomo - O átomo é um conjunto de matéria constituído de um núcleo carregado positivamente e de elétrons em número suficiente para equilibrar a carga positiva do núcleo constituído de nêutrons e de prótons. Elemento - Um elemento é um conjunto de átomos que tem o mesmo número de prótons no núcleo. Este número é conhecido como o número atômico do elemento. Por exemplo, todos átomos com seis prótons no núcleo são átomos do elemento carbono. O meio o mais eficaz de apresentar os elementos é a tabela periódica que agrupa os elementos segundo a suas propriedades. Composto químico - Um composto é uma substancia que tem uma razão fixa entre os elementos que determina sua composição, uma organização definida e suas propriedades químicas. Por exemplo, a água é um composto contendo hidrogênio e oxigênio numa razão de dois para um. Molécula: é um conjunto de átomos, iguais ou diferentes; é a menor porção de uma substância que pode existir livremente, exibindo todas as propriedades dessa substância. A molécula é constituída de dois ou mais átomos ligados quimicamente. Idéia Inicial de Moléculas: Em geral, os átomos não encontram isolados, mas se agrupam formando moléculas. Exemplos: 2 átomos de H se reúnem e formam uma molécula do gás hidrogênio. 2 átomos de O se juntam e formam uma molécula do gás oxigênio. 2 átomos de H e 1 átomo de oxigênio se agrupam e formam uma molécula de água. As moléculas é uma reunião de átomos que podem ser iguais ou diferentes. Substância- Todo tipo de matéria que apresenta características próprias. Exemplos: água, cloreto de sódio (sal de cozinha), bicarbonato de sódio, sacarose (açúcar comum), iodo, sulfato de cobre. Tipos de substancia: Cada substancia pode ser caracterizada pelo conjunto de átomos unidos numa determinada proporção; esse conjunto é denominado molécula ou, conforme o caso, reticulo cristalino. De acordo com os elementos formados das substâncias, estas podem ser: • Simples: quando formadas por átomos de um só elemento químico. • Compostas: quando formadas por átomos de dois ou mais elementos químicos. As substâncias são representadas, abreviadamente, por meio de fórmulas que indicam os elementos que as formam e a proporção entre seus átomos. Substância Simples: é formada por um único elemento químico (um só tipo de átomo na molécula). Exemplos: Substância Composta (ou composto): É formada por átomos de mais de um elemento químico (mais de um tipo de átomo na molécula). Exemplos: Diferença entre substância simples e substância composta: Substância Simples Átomos iguais nas moléculas (todas moléculas iguais) Substância Compostas Átomos diferentes nas moléculas (todas moléculas iguais) SUBSTÂNCIAS SIMPLES Oxigênio – O Ozone ou ozônio – O3 Hidrogênio – H2 Prata – Ag SUBSTÂNCIA COMPOSTA Água – H2O Gás carbônico – CO2 Àcido sulfúrico – H2SO4 Cloreto de soído – NaCl Mistura de Substâncias Mistura é um sistema formado por duas ou mais espécie de substâncias. Pode ser homogênea (água e sal dissolvido) ou heterogênea(água e areia). Exemplos: Deve-se observa que elemento químico tem como representação: o símbolo. Substância pura (simples ou composta) tem como representação: a fórmula. No entanto, mistura não tem representação específica. Normalmente é indicada pelos seus componentes. Exemplos: Mistura de água e açúcar, mistura de nitrogênio e gás carbônico, mistura de iodo e clorofórmio. Há, no entanto, misturas que têm nomes conhecidos: Ar atmosférico (N2, O2 e outros gases). Álcool 96° GL (96% de álcool e 4% de água) Gasolina (misturas de hidrocarbonetos) Misturas Homogêneas São aquelas que se apresentam como um todo uniforme, mesmo quando observadas através de microscópio. A porção uniforme de um sistema denomina-se fase. Assim, as misturas homogêneas são denominadas sistemas monofásicos. Exemplo: • Mistura de água e álcool comum; • Sal dissolvido na água; • Açúcar dissolvido na água; • Ouro 18 quilates; • Todas as misturas de substâncias gasosas; Etc. As misturas homogêneas podem ser separadas em seus componentes por processos físicos (mudanças de estado agregação), tais como cristalização, destilação, liquefação fracionada e fusão fracionada. Misturas Heterogêneas São aquelas que apresentam duas fases ou mais, observando a olho nu ou com algum aparelho de aumento. As misturas heterogêneas quando apresenta 2 fases é chamada de bifásica, se apresenta 3 fases, trifásica, mais de 4 fases chamamos de polifásica. Exemplo: • Pó de carvão na água; • Óleo na água; • Sangue; Etc. As misturas heterogêneas podem ser separadas por processos mecânicos, tais como: peneiração, separação magnética, filtração, decantação, centrifugação entre outros. Massa Atômica – Uma importante propriedade do átomo, portanto é a massa do átomo. Unidade de medida Mícron (µ). Massa Molecular – é a massa de uma molécula, ou seja, a soma das massas dos átomos componentes. Mol – Assim como ao falar em dúzia - não importa se de bananas, laranjas, pessoas, carros -, estamos nos referindo a uma quantidade - doze - de alguma coisa, quando nos referimos à dezena estamos nos referindo à quantidade dez de alguma coisa. Pois bem, quando falamos em mol, também estamos nos referindo a uma certa quantidade de alguma coisa. A única diferença entre dúzia, dezena e mol é a quantidade que representam. Se dúzia sugere imediatamente 12, dezena sugere 10, basta saber agora quanto o mol representa. A quantidade é bastante grande: 6,02 x 1023. Assim, se uma dúzia de laranjas corresponde a 12 laranjas, um mol de laranjas corresponde a 6,02 x 1023laranjas. Mas o que o mol mede? Nada. Mol não é uma unidade de medida, é uma quantidade. Você pode utilizar-se dele para indicar uma quantidade do que quiser mas, assim como usamos dúzia quando apropriado, tomaremos esse cuidado também com o mol. Você não vai à padaria e pede: "Por favor, poderia me fornecer 10- 23 mols ou moles de pães?” Embora possa fazer isso, o atendente provavelmente ficará olhando para você com cara de ponto de interrogação. É mais conveniente pedir meia dúzia de pães, embora as duas formas estejam se referindo à mesma quantidade. Na química, como lidamos com átomos e moléculas e estes são muito pequenos, uma pequena quantidade de qualquer substância possui um número muito grande deles. Neste caso, o mol é bastante apropriado e útil. Quantificando em mol Se você precisa se referir a 6,02 x 1023 moléculas, você pode dizer simplesmente 1 mol de moléculas. Se disserem a você que uma amostra contém meio mol de moléculas, você entenderá que existem 3,01 x 1023moléculas (6,02 x 1023 dividido por dois). O número de Avogadro Esse estranho número, 6,02 x 1023, recebeu o nome de número de Avogadroem homenagem a Amedeo Avogadro, físico italiano que trabalhou na teoria cinética dos gases e imortalizouse pela conhecida hipótese de Avogadro: "Volumes iguais de uma substância gasosa, nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas." Índice: é o número de átomos de um certo elemento em uma substância composta; ex: H3PO4 índices: 3, 1 e 4 (respectivamente). Íon - Um íon é um átomo ou uma molécula que possui uma carga elétrica. Cátions carregados positivamente (por exemplo, o cátion Na+ ) e anions carregados negativamente ( por exemplo o cloreto Cl- ) formam um sal neutro (por exemplo o cloreto de sódio NaCl). Ligação química - Uma ligação química é a força que mantém juntos os átomos nas moléculas. Reação química - As reações químicas são transformações da estrutura fina da molécula. Tais reações podem juntar duas moléculas para construir uma maior, quebrar uma molécula para produzir duas menores ou, por troca de átomos, constituir duas novas moléculas. Nas reações químicas, as ligações químicas são criadas ou rompidas.
Download