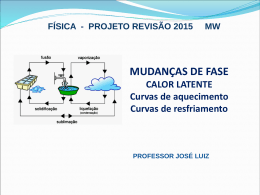
Matéria e Formas de Medida Química Geral – Prof. Dr. Élcio Rogério Barrak Engenharia de Produção - 1° semestre / 2008 Eduardo de Freitas Secaf Felipe Gomes Chuster 1- O que é a Química? O que essa ciência estuda? Por que estudála? - Química é a ciência que surgiu no século XVII a partir dos estudos de alquimia; trata das substâncias da natureza, dos elementos que a constituem, de suas características, propriedades combinatórias, processos de obtenção, suas aplicações e sua identificação. Estuda a maneira que os elementos se ligam e reagem entre si, bem como, a energia desprendida ou absorvida durante estas transformações. 2- Áreas de influência / relação / cotidiano. Engenharia Cosméticos Química a ciência central Bens de consumo Empresas alimentícias Indústria química Indústria de base Produtos hospitalares Definições Matéria: Tudo aquilo que possui massa e ocupa lugar no espaço Átomo: Partícula infinitamente pequena que combinada forma as moléculas Elemento químico: todos os átomos que possuem o mesmo número atômico (Z), ou seja, o mesmo número de prótons Tabela periódica: Traz informações acerca dos elementos químicos. É organizada em 18 colunas (famílias) e 7 linhas (períodos) Tipos de substâncias • Definição (átomos e moléculas) • Substância simples: formada por um único elemento químico (um só tipo de átomo na molécula). Ex.: H2, O2, O3 e P4 (fósforo branco) • Substância composta (composto): formada por mais de um elemento químico. Ex.: NaCl, NH3, HCl Propriedades das substâncias Estado sólido: forma e volume invariável Estado líquido: forma variável e volume invariável Estado gasoso: forma e volume variáveis Propriedades das substâncias •Densidade: g/cm³, g/ml, kg/m³ •Ponto de Fusão: ºC, K •Ponto de Ebulição: ºC, K Propriedades das substâncias • Solubilidade: g/100g de água • Calor específico: J/g ºC Gráfico de solubilidade x temperatura Propriedades das substâncias Separação de misturas • Mistura (mais de uma espécie de molécula) • Mistura homogênea (solução); água e álcool • Mistura heterogênea; água e óleo • Processos: * Separação magnética. Ex. : pregos e cloreto de sódio Separação de misturas * Destilação simples * Destilação fracionada. Ex.: destilação do petróleo • Filtração. Tem a função de separar sólidos de líquidos. • Instrumentos: suporte universal, pipeta, papel de filtro, erlenmayer • Ex.: água e areia • Ex. prático: água e café Aplicações • Tratamento da água A radiação solar aquece a água salgada e o vapor d’água se condensa na superfície de vidro, escorrendo para o frasco contendo água destilada. Sistema internacional de medidas (SI) O SI foi criado afim de padronizar internacionalmente as medidas e grandezas físicas para melhor entendimento e aplicação de tais conceitos. Formas de Medida Instrumentos e grandezas comuns nos laboratórios de química: • Comprimento: usa-se régua graduada em centímetros (cm) • Volume: usam-se os seguintes instrumentos, onde a unidade básica é o mililitro (mL) 1 L = 1000 mL = 1000 cm³ Conversão de Unidades Comprimento: Volume: Massa: S.I. metro cubico / m3 S.I. quilograma / kg 1 km = 103 m 1 L = 1000 mL = 1000 cm3 1 kg = 103 g 106 = mega; 10-1 = deci 1 mL = 1 cm3 1 mg = 10-3 g Temperatura: Pressão: Energia: S.I. kelvin / K (centigrados) S.I. pascal / Pa S.I. °C = grau Celsius 1 atm = 760 mmHg = 1 cal = 4,184 J °F = grau Fahrenheit 1,013 x 105 Pa; S.I. metro / m 1 m = 100 cm = 1000 mm 1 mm = 10-3 m 1 cm = 10-2 m 10-2 = centi; 10-3 = mili 10-6 = micro; 10-9 = nano K = °C + 273,15 °F = 1,8(°C) + 32 joule / J • Temperatura: usa-se o termômetro de mercúrio (Hg) graduado em graus Celsius (ºC) TK = TºC + 273,15 TºF = 1,8 TºC + 32 • Massa : usa-se a balança de dois pratos ou a balança eletrônica, onde a unidade básica é o grama (g) • Pressão: usa-se o barômetro e a unidade S.I. é o pascal (Pa), sendo atm e mmHg comumente utilizadas Incertezas nas medidas Toda medida envolve certo grau de incerteza. Ela depende também do instrumento escolhido para realizar a medição e da habilidade de quem o utilizará. Ex.: 3 ± 3,0 ± 3,00 ± 1 0,1 0,01 mL mL mL Portanto, quanto maior a quantidade de algarismos significativos menor é a margem de erro, ou seja maior a exatidão da medida . Algarismos Significativos • Todos dígitos diferentes de zero são “A.S.” Ex.: 8,91 mm (3 A.S.) 5,979 m (4 A.S.) • Zeros entre dígitos diferentes de zero são “A.S.” Ex.: 507 g (3 A.S.) 2,09 g (3 A.S.) • Zeros além do ponto decimal no fim de um número são “A.S.” Ex.: 9,0 mL (2 A.S.) • Zeros que precedem o primeiro dígito diferente de zero em um número não são “A.S.” Ex.: 0,0004 g (1 A.S. que é o número 4 no final) OBS.: Podemos e devemos expressar os números decimais adotando a notação exponencial, no caso de 0,4 g teríamos 4 10-1 g e isso nos levaria a dizer que o número tem 1 A.S. Ou ainda, 4,0 10-1 g e isso nos levaria a ter 2 A.S. • Em operações, como na multiplicação ou na divisão, o total de A.S. do resultado é igual ao da grandeza com o menor número de A.S. Ex.: 6,221 x 5,2 = 32,3492 = 32 • Na adição ou na subtração, o número de dígitos após o ponto decimal no resultado é igual ao da quantidade com o menor número de dígitos após o ponto decimal. Ex.: 15,32 g + 0,9 g + 117 g = 133,22 g = 133 g Conseqüentemente a incerteza associada neste caso será de ± 1g Análise Dimensional A análise dimensional é usada para certificar que os cálculos com várias unidades produzirão as unidades corretas no resultado e também na conversão de unidades. Esquema prático de conversão de unidades Análise Dimensional Exercício 1.6 do livro texto. Quando 1 grama de gasolina é queimada num automóvel, a quantidade de energia liberada é de cerca de 1,03 x 104 cal. Expresse esse valor em joules. Solução: Usamos o fator de conversão 4,184 J / 1 cal. *A idéia básica do uso do fator de conversão é realizar uma multiplicação simples (regra de três), cancelando a unidade que se quer cortar. Se necessário, usam-se sucessivos fatores de conversão até que se obtenha a quantidade nas unidades desejadas. 1,03 x 104 cal x 4,184 J / 1 cal = 4,31 x 104 J (3 A.S.) Método Científico O método científico é uma abordagem geral de problemas que envolve observar, procurar padrões nas observações, formular hipóteses para explicar as observações e testá-las em experimentos posteriores. As hipóteses que resistem a tais testes, e mostram-se úteis em explicar, ou prever um comportamento, tornam-se teorias. Química na atualidade A nanotecnologia se apresenta como uma das mais importantes inovações técnicas e científicas da atualidade, tal descoberta apresenta enorme relevância, já que a partir dela é possível manipular a matéria com precisão atômica. Ela promete alterações nos tamanhos dos dispositivos técnicos, facilitando o armazenamento de dados e a utilização de sistemas ultra-rápidos de comunicação. Portanto a nanotecnologia promete fazer uma renovação que facilitará em muitos aspectos a vida humana. Aplicações da nanotecnologia Conclusão A Química é uma ciência experimental que estuda a matéria, suas propriedades, composição, estrutura e reações. Essa ciência é de fundamental importância para a vida e a sobrevivência do homem. A partir dela é possível evoluir e criar formas práticas que nos ajudam a se adaptar aos mais diversos contextos e situações. Ou seja, a química está presente em tudo, podemos dizer que de certa forma ela é inerente à vida humana.
Download