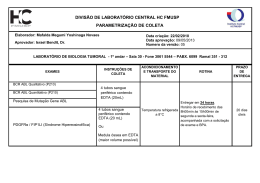
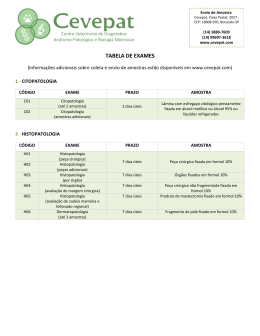
INDICADORES DE ÍONS METÁLICOS • É um composto cuja cor muda quando ele se liga a um íon metálico; • Para um indicador ser utilizável ele deverá ligar-se ao metal menos fortemente que o EDTA; • Exemplo: análise típica de titulação de Mg com EDTA utilizando negro de eriocromo T como indicador: MgIn + EDTA MgEDTA + In vermelho incolor incolor azul • Se um metal não se dissocia livremente de um indicador diz-se que o metal bloqueouo indicador. O negro de eriocromo T é bloqueado pelo Cu2+, Ni2+, Co2+, Fe3+ e Al3+. TÉCNICAS DE TITULAÇÃO COM EDTA 1. Titulação direta O constituinte é titulado com uma solução padrão de EDTA, em uma solução tamponada em um pH apropriado. Podese utilizar uma agente complexante complementar como amônia, tartarato, citrato ou trietanolamina, para evitar que o íon metálico forme precipitado na ausência de EDTA. TÉCNICAS DE TITULAÇÃO COM EDTA 2. Titulação de retorno Um excesso conhecido de EDTA é adicionado ao titulado. O excesso é então titulado com uma solução-padrão de um segundo íon metálico. É necessária se o titulado precipita na ausência do EDTA, se ele reage muito lentamente com EDTA sob as condições da análise ou se ele bloqueia o indicador. O íon metálico usado na titulação de retorno não deve deslocar o complexo formado pelo íon metálico em análise com EDTA. TÉCNICAS DE TITULAÇÃO COM EDTA 3. Titulação de deslocamento: Utilizada para íons metálicos que não possuem um indicador satisfatório. O constituinte em análise normalmente é tratado com um excesso de Mg(EDTA)2para deslocar o Mg2+, que é posteriormente titulado com solução de EDTA padrão. Mn+ + MgY2- MYn-4 + Mg2+ O Hg2+ é determinado desta maneira. A constante de formação do Hg(EDTA)2- deve ser maior que a constante de formação do Mg(EDTA)2- ou o deslocamento do Mg2+ do Mg(EDTA)2- não ocorrerá. TÉCNICAS DE TITULAÇÃO COM EDTA 4. Titulação indireta: Utilizada para ânions que precipitam com certos íons metálicos. Por exemplo: O sulfato pode ser analisado pela precipitação com excesso de Ba2+ em pH 1. O BaSO4(s) é lavado e então fervido com um excesso de EDTA em pH 10 para levar o Ba2+ de volata a solução como Ba(EDTA)2-. O excesso de EDTA é titulado por retorno com uma solução de Mg2+. • Ânions como carbonato, cromato, sulfeto e sulfato podem ser determinados pela titulação indireta com EDTA. MASCARAMENTO • O mascaramento é utilizado para evitar que um elemento interfira na análise de outro elemento. Um agente de mascaramento é um reagente que protege algum componente do constituinte da reação com EDTA. • O cianeto, o fluoreto, a tiouréia e a trietanolamina são exemplos de agente mascarante. • Por exemplo: o Al3+ em uma mistura de Mg2+ e Al3+ pode ser titulado mascarando antes o Al3+ com F-, deixando assim apenas o Mg2+para reagir com o EDTA. • O DESMASCARAMENTO libera o íon metálico de um agente de mascaramento. • A seletividade produzida pelo mascaramento/desmascaramento permite que componentes individuais de misturas complexas de íons metálicos seja analisados por titulação com EDTA
Download