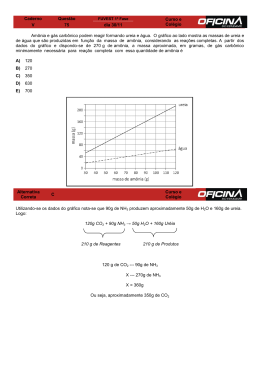
Método de Haber Bosch A amônia (NH3) é um dos produtos químicos mais importantes para o ser humano, sendo uma das cinco substâncias produzidas em maior quantidade no mundo. Sua importância está relacionada ao seu uso direto como fertilizante e por se constituir matéria-prima para a fabricação de outros fertilizantes nitrogenados. A amônia também é utilizada na produção de explosivos de plásticos. Em 1898, Sir William Ramsey (1852-1916) – o descobridor dos gases nobres – previu uma catástrofe para a humanidade: a escassez de fertilizantes nitrogenados para meados do século XX, o que provocaria uma redução desastrosa na produção de alimentos em todo o mundo. Na época, o nitrogênio era obtido de depósitos naturais de nitratos de sódio (NaNO3) e potássio (KNO3) ou de excrementos de aves marinhas (guanos). A catástrofe prevista por Ramsey não ocorreu graças ao trabalho de dois alemães: o químico Fritz Haber (1868-1934) e o engenheiro William Carl Bosch (1874-1940). Eles criaram um processo no qual conseguiram sintetizar a amônia a partir de seus elementos constituintes. Fritz Haber (1868-1934), Prêmio Nobel de Química, em 1918, por ter desenvolvido um método eficaz de síntese da amônia. O processo criado por Haber permitiu que a Alemanha reduzisse consideravelmente o custo de fabricação de explosivos durante a primeira guerra mundial. Ele observou que a amônia, por oxidação, produz o acido nítrico – essencial para a produção de pólvora. Apesar dos serviços prestados à pátria, Haber, por ser judeu, foi perseguido pelos nazistas, tendo de fugir da Alemanha, em 1933, para não ser morto por seus compatriotas. equação e a figura a seguir mostram a reação de obtenção de amônia e as condições industriais nas quais ela ocorre Temperatura: 400 a 600 °C Pressão: 140 a 340 até Catalisador: FeO com pequenas impurezas de AlO, MgO, CaO e K2O A partir dessas informações e conhecendo o Principio de Le Chatelier, podemos prever as condições que favorecem a produção de grandes quantidades de NH3: a) baixas temperaturas Como a reação é exotérmica, a diminuição da temperatura provoca um deslocamento de equilíbrio para a direita. b) altas pressões O aumento de pressão provoca contração de volume, o que desloca o equilíbrio para o lado direito, ou seja, para o lado de menor volume. c) remoção do NH3 formado Quanto mais intensa e rápida for a retirada do NH3, mais intensamente o equilíbrio será deslocado para a direita. d) catalisador Embora o catalisador não desloque o equilíbrio, ele aumenta a velocidade das reações, permitindo que o equilíbrio seja alcançado mais rapidamente. No processo de Haber – Bosch, a amônia é produzida a altas temperaturas, o que aparentemente contraria o Principio de Le Chatelier. Mas essa aparente contradição pode ser explicada. Teoricamente, a altas pressões e à temperatura ambiente, o rendimento da síntese da amônia é de 90%, porem, nessas condições, a reação é muito lenta e o tempo necessário para atingir o equilíbrio é tão grande que os custos de produção tornariam o processo economicamente inviável. A reação, então, é realizada a altas temperaturas, o que aumenta a sua velocidade e, portanto, diminui consideravelmente o tempo necessário para alcançar o equilíbrio. A 500 e 200 atm, embora o rendimento da reação seja de apenas 20%, o equilíbrio é alcançado em menos de 1 minuto. Se a elevação da temperatura diminui o rendimento da reação, os outros fatores que a favorecem – a pressão, o catalisador e a retirada rápida da amônia produzida – deslocam o equilíbrio no sentido de aumentar a produção de amônia, viabilizando economicamente esse processo. a foto mostra o primeiro reator utilizado na síntese de Haber-Bosch, realizada em 1913 pela Badische Anilinin und Soda Fabrik (BASF)) • Sal de amônio tratado com base forte: NH4Cl + NaOH NaCl + H2O + NH3 Há formação de hidróxido de amônio que, na presença de aquecimento e base forte, se decompõe. • Hidrólise de nitretos metálicos: Mg3N2 + 3H2O 2NH3 + 3Mg(OH)2 • Gás incolor de Ação pungente que pode ser tóxico em níveis elevados • PF= -78°C, PE= -33°C, PM= 17u, •Usada principalmente na fabricação de fertilizantes (sulfato de amônio, fosfato de amônio, nitrato de amônio e uréia.) • Explosivos, fibras, plásticos e produtos de limpeza. • Pertence ao grupo dos hidretos (EH3), compostos simples do grupo 15. A hidrazina (N2H4) também é uma hidreto. • Estrutura espacial: • Como fluido usado na refrigeração, a amônia apresenta numerosas características e vantagens, sendo as mais importantes as seguintes: • Possui boas propriedades termodinâmicas, de transferência, de calor e de massa, em particular dentro das condições definidas pelos serviços e o rendimento das máquinas utilizando amoníaco é dos melhores. • É quimicamente inerte para os elementos dos circuitos frigoríficos, com exceção do cobre. • O amoníaco não se mistura com o óleo lubrificante. • É facilmente detectável em caso de fuga por apresentar um odor pungente muito característico, desta forma, é muito difícil ter uma falha de circuito. • A amônia é fabricada para muitos mais usos além da refrigeração, o que permite a manutenção do seu preço baixo e acessível. Em qualquer caso, o preço do amoníaco é muito inferior ao custo total da maioria dos outros refrigerantes e para além disso, quantidades inferiores permitem o mesmo efeito.
Download