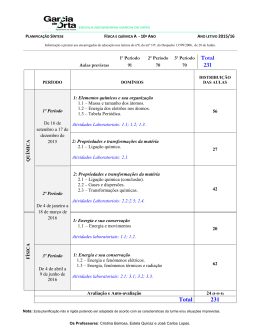
E.S. de Valença “Preparação duma solução de CuSO 4 5 H 2 O e posterior diluição” Realizado por: Tiago Afonso nº21 10ºB Grupo 3 (turno 2) Valença, 5 de Fevereiro de 2004 Índice Pág. 1. Introdução 2 2. Procedimento experimental 4 3. Resultados 8 4. Cálculos 9 5. Discussão de resultados 10 6. Conclusão 11 7. Bibliografia 12 Técnicas laboratoriais de química – Bloco I – A.L2.1 1 1 . Introdução Em primeiro lugar convém recordar que o manuseamento de reagentes implica o conhecimento das normas de segurança a respeitar, bem como as propriedades próprias do soluto, que obrigam a procedimentos particulares, nomeadamente o uso de luvas, uso de banho de gel……… A preparação laboratorial de soluções com uma dada composição exige que se cumpram determinados passos, independentemente de se pretender um título rigoroso [solução padrão (aquela solução cuja concentração é rigorosamente conhecida)] ou não muito rigoroso. Dentro das soluções, existem três categorias: soluções diluídas, concentradas e saturadas. Quanto maior for a quantidade de soluto presente num dado volume de solução, maior é a sua concentração. Por isso, nas soluções mais concentradas existe maior quantidade de soluto do que nas soluções diluídas, para um mesmo volume de solução. Nas actividades laboratoriais que foram efectuadas (e que vão ser neste relatório abordadas por assim dizer), o soluto utilizado foi o Sulfato de Cobre Pentahidratado (CuSO 4 5 H 2 O). Este sólido, está destinado às indústrias de nutrição animal, como suplemento em sal mineral, como fonte de cobre nas formulações de fertilizantes em geral (líquidos e sólidos), algicidas, pigmentos, anodização de alumínio, indústrias cerâmicas, fritas, micronutrientes, etc… Depois desta breve tomada de conhecimentos, já nos encontramos o suficientemente informados para iniciarmos a experiência. Por isso, podemos desde já indicar os objectivos pretendidos com a realização desta actividade laboratorial, sendo esses os seguintes: Técnicas laboratoriais de química – Bloco I – A.L2.1 2 ü Preparar 100,0 cm 3 duma solução de 0,030 mol dm −3 a partir do sólido CuSO 4 5 H 2 O; ü Preparar uma solução diluída a partir duma mais concentrada (a anterior), tendo em conta o factor de diluição 2,5 (que vai ser indicado mais adiante neste relatório). Técnicas laboratoriais de química – Bloco I – A.L2.1 3 2 . Procedimento Experimental 2.1 – Preparação de 100,0 cm 3 de uma solução 0,030 mol dm −3 a partir do sólido CuSO 4 5 H 2 O (sulfato de cobre penta-hidratado) v Material utilizado: ü Esguicho; ü Balança Semianalítica; ü Vidro de Relógio; ü Espátula; ü Vareta; ü Gobelé; ü Balão Volumétrico 100ml ±0.1ml IN A 20ºC; ü Funil; ü Conta-gotas. v Procedimentos realizados: ü Colocamos o vidro de relógio sobre a balança analítica e taramo-la; ü Com o auxílio de uma espátula, deitamos CuSO 4 5 H 2 O aos poucos no vidro de relógio até obter 0.75g; ü Tiramos o vidro de relógio de cima da balança e voltamos a colocá-lo sobre ela; ü Repetimos o procedimento anterior e registamos os resultados obtidos; ü Deitamos o CuSO 4 5 H 2 O para um gobelé e com o esguicho “limpámos” as paredes do vidro de relógio para que o sólido ficasse todo no gobelé; Técnicas laboratoriais de química – Bloco I – A.L2.1 4 ü Deitamos um pouco de água desionizada com o esguicho e de seguida agitámos com a vareta de modo a dissolver o mais possível o soluto; ü Colocamos o funil na boca do balão volumétrico e com o auxílio da vareta transvazamos a solução para dentro do balão; ü Deitamos um pouco mais de água no gobelé e transvazamos de novo a solução para o balão volumétrico, de maneira a que não ficassem restos do soluto no gobelé; ü Colocamos a rolha no balão e agitamo-lo para homogeneizar a solução; ü Quando verificamos que a solução estava bem dissolvida, acrescentamos água ao balão (com o esguicho), até perto do traço de referência (100 ml) e em seguida, com o conta-gotas, até ao respectivo traço; Técnicas laboratoriais de química – Bloco I – A.L2.1 5 ü Finalmente, rolhamos novamente o balão, agitamo-lo para proceder à homogeneização da solução e colocamos um rótulo com a sua identificação e outros itens. 2.2 – Preparação duma solução diluída a partir de uma mais concentrada, tendo em conta o factor de diluição 2,5. v Material utilizado: ü Esguicho; ü Pipetador Universal; ü Pipeta Volumétrica classe A 20ml ±0,038ml EX 20ºC; ü Balão Volumétrico 100ml classe A IN ± 0,1ml 20ºC ü Conta-gotas. v Procedimentos efectuados: ü Pipetamos 40 ml da solução obtida anteriormente; ü Colocamos esse extracto de solução num balão volumétrico de 100ml; Técnicas laboratoriais de química – Bloco I – A.L2.1 6 ü Com o esguicho, deitamos água no balão até chegar perto do traço de referência (que marcava 100ml) e em seguida com o conta-gotas até ao traço; ü Por fim, rotulámos balão volumétrico, com a sua identificação. Técnicas laboratoriais de química – Bloco I – A.L2.1 7 3 . Resultados 3.1 - Preparação de 50,0 cm 3 de uma solução 0,030 mol dm −3 a partir do sólido CuSO 4 5 H 2 O (sulfato de cobre pentahidratado) Tabela 1 – Medição da massa do sólido na balança “Semianalítica” de sensibilidade ± 0.01 g Ensaio Massa (gramas) 1 0,75 2 0,75 3 0,75 Técnicas laboratoriais de química – Bloco I – A.L2.1 8 4 . Cálculos 4.1 - Preparação de 50,0 cm 3 de uma solução 0,030 mol dm −3 a partir do sólido CuSO 4 5 H 2 O (sulfato de cobre pentahidratado) Dados: Cálculos efectuados: CuSO 4 5 H 2 O 1. n= 0.030 x 100x10 −13 ó n= 0.003 mol V=100cm 3 =100ml C=0.030 mol/dm −3 m ó m= 0.003 x 249.62 ó m= v 0.75g (aprox.) 2. Cm= 4.2 - Preparação duma solução diluída a partir de uma mais concentrada, tendo em conta o factor de diluição 2,5. Factor de diluição = Vfinal=100ml F.d.= 2,5 Vinicial= ? Vfinal Vinicial Cálculos efectuados: F.d. = Vfinal 100 ó 2,5 = ó Vinicial Vinicial ó Vinicial= Técnicas laboratoriais de química – Bloco I – A.L2.1 100 ó Vinicial= 40ml 2,5 9 5 . Discussão de Resultados Primeiramente penso que se deve referir que as classes (A e B) atribuídas ao material utilizado têm a ver com a sua “classe” de erro (para mais informações consultar a tabela de normas de tolerância da pág. 60 do livro “Técnicas Laboratoriais de Química – Bloco I ” da Porto Editora). Os resultados que obtivemos variam minuciosamente conforme o erro do material utilizado e dos erros cometidos durante as medições pelo operador; por isso se pode verificar na tabela de resultados que para obtermos uma medida exacta, devemos sempre realizar o procedimento no mínimo três vezes para depois se obter uma média que vai ser somada/subtraída com o erro do material ou desvio médio. Deve-se salientar também que grande parte dos operadores inexperientes comete erros que se devem tentar evitar como por exemplo quando vão observar uma medida, observam-na na vertical e não na horizontal, sendo esta a posição correcta (ver imagem em nos Anexos). E, parecendo que não, esta é uma regra muito importante pois se não a praticarmos correctamente, o erro dos resultados das medições vai ser ainda maior. Para finalizar, há ainda um destaque a fazer que no meu entender trata-se de um pormenor importante, pois a diluição foi feita a partir duma solução realizada anteriormente a esta, poupando o soluto (CuSO 4 5 H 2 O) e evitando gastos desnecessários deste, ou seja, não fizemos uma nova solução mas sim apoveitamos a solução já preparada para fazer uma diluição como consta nos objectivos desta actividade laboratorial. Técnicas laboratoriais de química – Bloco I – A.L2.1 10 6 . Conclusão Com a realização e conclusão desta actividade laboratorial, penso que os objectivos foram cumpridos pois os resultados foram concordantes com estes, ou seja, a preparação da solução e a posterior realização duma solução mais diluída foram concluídas com êxito e como era esperado/previsto. O único senão aquando a realização da actividade laboratorial foi a de que fomos obrigados a utilizar um balão volumétrico de 100 ml para preparar a primeira solução quando o correcto seria um balão de 50ml e isto devido à falta de material no laboratório. Técnicas laboratoriais de química – Bloco I – A.L2.1 11 7 . Bibliografia • SIMÕES, Teresa Sobrinho; QUEIRÓS, Maria Alexandra; SIMÕES, Maria Otilde: Técnicas Laboratoriais de QuímicaBloco I; Porto Editora; Porto; • MENDONÇA, Lucinda Santos; DANTAS, Maria da Conceição; RAMALHO, Marta Duarte; Jogo de Partículas, Química 10ºano; Texto Editora; Lisboa • http://www.prof2000.pt:9999/users/norberto/Amadora_0 2_03/default.asp Técnicas laboratoriais de química – Bloco I – A.L2.1 12 8 . Anexos Visualização correcta Regras de Segurança a ter com o CuSO 4 5 H 2 O (sulfato de cobre pentahidratado): a) Manter fora do alcance das crianças; b) Nocivo por ingestão; c) Irritante para os olhos e para a pele. Técnicas laboratoriais de química – Bloco I – A.L2.1 13
Download