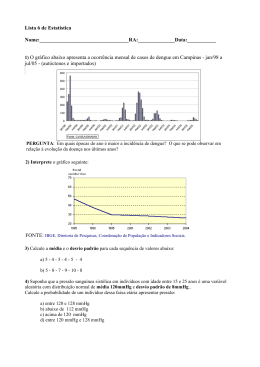
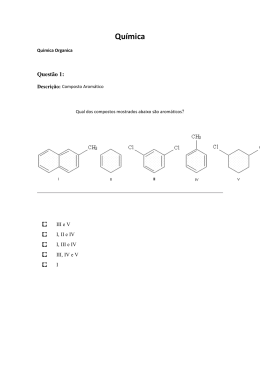
4º Q14 T A 28/10/2008 Esta prova contém 10 questões. PF - INSTRUÇÕES: Verifique se sua prova está completa. Preencha corretamente todos os dados solicitados no cartão de respostas. Cartões com rasura ou incompletos serão invalidados. Em caso de dúvida, chame o responsável pela sala. Utilize os espaços em branco para rascunho. Duração da prova: 50 minutos. Guarde esta prova. Ela poderá ser utilizada como material de aula. Questões com crédito de vestibular podem ter sido alteradas em sua redação ou dados. Boa prova! 1) Um recipiente contém 4,0 g de metano(CH4) e 21,0 g de nitrogênio(N2). Se, a uma dada temperatura , a pressão do sistema é de 800 mmHg, as pressões parciais de CH4 e N2 são, respectivamente: Dados : massas molares (g/mol): H =1, C =12, N=14. a) b) c) d) e) 500 mmHg e 300 mmHg 400 mmHg e 400 mmHg 300 mmHg e 500 mmHg 200 mmHg e 600 mmHg 100 mmHg e 700 mmHg 2) As bexigas A e B podem conter, respectivamente: Dados: ao nível do mar e a 25º C – volume molar de gás = 25 L /mol, densidade do ar atmosférico = 1,2 g / L R=0,082 atm.L/ mol. K Massas molares(g/mol): H=1, O=16,C=12,N=14, He=4, Xe=131. a) b) c) d) e) xenônio e amônia. dióxido de carbono e amônia. Amônia e metano. Metano e amônia. Hélio e xenônio. 3) A produção de carboidratos (fórmula mínima CH2O) pelas plantas verdes obedecem à equação geral da fotossíntese: CO2 H 2 O CH 2 O O2 Quantos litros de gás carbônico, medidos nas CNTP, serão necessários para produzir 45g de carboidrato? Dados: massas molares H=1g/mol; C=12g/mol; O=16g/mol e volume molar (nas CNTP)=22,4L/mol. a) b) c) d) e) 11,2L 22,4L 7,5L 33,6L 40,0L 4) As porcentagens de nitrogênio e oxigênio presentes na substância NH4NO3 são, respectivamente: (Dados : massas atômicas H = 1u ; O = 16u ; N = 14u ) a) 17,5% e 77,5% b) 35,0% e 60,0% c) 25,4% e 38,4% d) 40,0% e 60,0% e) 2,5% e 4,75% 5) Uma certa quantidade de um composto contendo potássio, cromo e oxigênio foi analisada, obtendo-se os seguintes valores: 1,98 g de potássio, 3,96 g de cromo e 4,06 g de oxigênio. A fórmula correta do composto é: (Dados: massas atômicas: K = 39u ; Cr = 52u ; O = 16u) a) b) c) d) e) KCrO2 KCrO3 K2CrO4 K2Cr2O7 K2Cr3O10 6) A combustão da grafite é representada por: H = - 94 kcal/mol C (grafite) + O2 (g) CO2 (g) A energia térmica requerida para dissociar 88g de gás carbônico em carbono grafite e oxigênio, em kcal, é: (Dado: CO2 = 44g/mol) a) 44 b) 66 c) 94 d) 188 e) - 94 7) Os compostos I e II representados abaixo pertencem respectivamente às funções orgânicas: O I- C H H O II- a) b) c) d) e) I ácido carboxílico aldeído ácido carboxílico aldeído fenol II álcool fenol cetona álcool cetona O H O 8) Quais funções orgânicas estão presentes na estrutura representada abaixo? C H C H3 C H O a) b) c) d) e) aldeído e álcool ácido carboxílico e álcool cetona e aldeído ácido carboxílico e cetona álcool e cetona 9) Identifique a alternativa que corresponde ao nome do composto que apresenta a fórmula estrutural a seguir: H3C CH CH2 CH2 CH2 CH CH3 CH3 OH a) b) c) d) e) 6 - metil - 2 - heptanol 2 - metil - 6 - heptanol 1,5 - dimetil - 1 - hexanol 6 - metil - 2 - heptanal 2,6 - dimetil - 1 - heptanol 10) Qual é o nome oficial do composto mostrado abaixo? O H3C – CH2 – CH2 – CH2 – C – OH a) b) c) d) e) pentanal 2 - pentanona ácido pentanóico 1 - pentanol pentano
Download