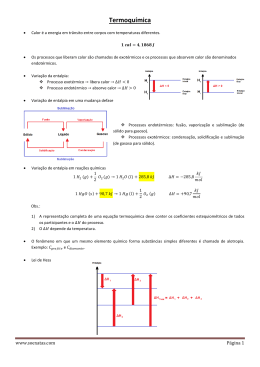
TERMOQUÍMICA 1 Introdução A sociedade moderna depende das mais diversas formas de energia para sua existência. Quase toda a energia de que dependemos é obtida a partir de reações químicas, como a queima de combustíveis fósseis, as reações químicas ocorridas em baterias ou a formação de biomassa por fotossíntese, além dos processos biológicos que atuam em nosso corpo. A relação entre as modificações químicas e energia pode ser mostrada de diversas formas. Por exemplo, as reações químicas com alimentos e combustíveis liberam energia enquanto a quebra da água em hidrogênio e oxigênio demanda absorção de energia elétrica. A fotossíntese converte a energia radiante do sol em energia química. Os processos químicos podem tanto gerar calor como realizar trabalho como acionar a ignição de um carro. Desta forma podemos dizer que qualquer mudança química geralmente envolve energia. O estudo da energia e suas transformações é conhecido como termodinâmica. Essa área de estudo teve seu início durante a revolução industrial quando as relações entre calor, trabalho e conteúdo energético de combustíveis foram estudados no esforço de se maximizar o desempenho de motores a vapor. A termoquímica é a parte da termodinâmica que examina as relações entre as reações químicas e sua estequiometria. Uma transformação química sempre envolve uma troca de calor. As transformações que liberam calor são exotérmicas; as que absorvem calor são endotérmicas. O conteúdo de calor associado a uma substancia é chamado de entalpia (H). Quando uma reação é realizada sob pressão constante, a quantidade de calor liberada ou absorvida recebe o nome de variação de entalpia (∆H). 2 Variação de entalpia (∆H) A variação de entalpia indica a quantidade de calor envolvida em uma transformação. É determinada pela diferença entre as entalpias dos produtos e a dos reagentes. ∆H = H(produtos) – H(reagentes) 2.1 Reação endotérmica Nas reações endotérmica a entalpia do sistema aumenta: ∆H é positivo. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Neste tipo de reação, o produto é mais energético do que os reagentes, isto é, a quantidade de energia armazenada nos produtos é maior do que a quantidade de energia armazenada nos reagentes. ∆H = H(produtos) – H(reagentes) > 0 Exemplo: ½ N2(g) + O2(g) NO2(g) ∆H = +33,2 kJ 2.2 Reação exotérmica Na reação exotérmica a entalpia do sistema diminui: ∆H é negativo. Neste tipo de reação, os reagentes são mais energéticos do que o produto, isto é, a quantidade de energia armazenada nos reagentes é maior do que a quantidade de energia armazenada no produto. ∆H = H(produtos) – H(reagentes) < 0 Exemplo: H2(g) + ½ O2(g) H2O (l) ∆H = -286kJ Figura 1: Entrada e saída de calor no sistema 3 Diagrama de Entalpia O diagrama de entalpia mostra a posição relativa das entalpias armazenadas nas substâncias que reagem ou que são formadas. Ele indica a variação de entalpia (∆H) envolvida na transformação de reagentes em produtos. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Figura 2: Diagrama de entalpia 4 Principais Fatores que Afetam o ∆H de uma reação 4.1 Quantidade de reagentes A quantidade de calor envolvida em uma reação química depende da quantidade dos reagentes e dos produtos. H2(g) + ½ O2(g) H2O (l) ∆H = -286 kJ 2H2(g) + O2(g) 2H2O (l) ∆H = -572 kJ 4.2 Estado físico das substâncias Gasoso: H2(g) + ½ O2(g) H2O (g) ∆H = -243 kJ Líquido: H2(g) + ½ O2(g) H2O (l) ∆H = -286 kJ ∆H = -292 kJ Sólido: H2(g) + ½ O2(g) H2O (s) Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Á água formada em estados físicos diferentes altera a entalpia da reação. Observe o gráfico a seguir Figura 3: Estabilidade entre os estados da matéria. As moléculas de água que se encontram no estado sólido apresentam um grau de agitação menor (mais estável) do que as moléculas que estão nos estados líquido e gasoso. 4.3 Alotropia A variedade alotrópica mais abundante na natureza é a mais estável (menor entalpia), e a menos abundante, a mais instável (maior entalpia). Exemplos: O carbono grafite é mais estável do que o carbono diamante. O fósforo vermelho é mais estável do que o fósforo branco. O enxofre rômbico é mais estável que o enxofre monoclínico. 4.4 Temperatura Quando a temperatura varia, muda o grau de agitação das moléculas consequentemente, varia a entalpia dos participantes. Exemplos: H2(g) + Cl2(g) 2 HCl ∆H = 183,9 kJ a 15 oC H2(g) + Cl2(g) 2 HCl ∆H = 184,1 kJ a 75 oC Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 e, 5 Tipos de Calores de Reação 5.1 Entalpia ou calor de formação É a variação de entalpia associada à reação de síntese (formação) de 1 mol do composto a partir de substâncias simples no estado padrão. Substância simples no estado padrão: ∆Hf = 0 Estado-padrão: forma física e alotrópica mais abundante da substância a 25 oC e 1 atm. Exemplo: H2(g) + ½ O2(g) H2O(l) C(grafite) + O2(g) CO2(g) ∆Hfo = -68,3 kcal/mol ∆Hfo = -94,1 kcal/mol 5.2 Entalpia ou calor de combustão É a variação de entalpia associada à combustão (queima) de 1 mol de substância a 25 oC e 1 atm com excesso de oxigênio. Exemplos: CH4(g) + O2(g) CO2(g) + H2O(l) C2H5OH(l) + 3O2(g) CO2(g) + 3H2O(l) ∆H = -890 kJ/mol ∆H = -1368 kJ/mol O ∆H de combustão refere-se sempre a 1 mol da substância que sofre combustão. O ∆H de combustão é sempre negativo, pois as reações de combustão são sempre exotérmicas. 6 Lei de Hess O estudo da termoquímica se fundamenta nos trabalhos do químico suíço Germain Henry Hess (1802-1850). Em 1840, Hess enunciou uma lei que nos permite calcular a variação de entalpia (∆H) teórica de uma reação qualquer, mesmo que sua determinação experimental seja difícil. A lei de Hess estabelece que se uma reação for executada em uma série de etapas, o ∆H para a reação será igual à soma das variações de entalpia para as etapas individuais. A variação de entalpia total para o processo é independente do número de etapas ou da natureza particular Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 da maneira pela qual a reação é executada. Podemos calcular o ∆H para qualquer processo, desde que encontremos uma rota por que ∆H seja conhecido para cada etapa. Isso significa que um número relativamente pequeno de medidas pode ser usado para calcular o ∆H para um vasto número de reações diferentes. “A variação de entalpia (∆H) de uma reação depende apenas do estado inicial dos reagentes e do estado final dos produtos, não dependendo dos estados intermediários, ou seja, ∆H = Hf – Hi.“ Figura 4: Ilustração Lei de Hess Exemplo: Qual o ∆H da reação: C(s) + O2(g)CO2(g), sabendo que essa reação ocorre em duas etapas? 1ª C(s) + ½ O2(g)CO(g) ∆H1 = -110 kJ 2a CO(g) + ½ O2(g)CO2(g) ∆H2 = -283,5 kJ ∆H = ∆H1 + ∆H2 Vejamos uma ilustração da lei de Hess da reação de combustão do metano. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Figura 5: A quantidade de calor gerada pela combustão de 1 mol de CH4 independe se a reação ocorre em uma ou mais etapas. 6.1 Utilização de entalpias de formação para o cálculo de entalpias de reação, ∆H. Um outro processo, que é uma nova aplicação da lei de Hess, para calcularmos o ∆H de uma equação-problema é através dos calores de formação dos reagentes e produtos. O ∆Hfo tabuladas têm muitas utilizações importantes. Podemos usar a lei de Hess para calcular a variação de entalpia padrão para qualquer reação da qual conhecemos os valores de ∆Hfo para todos os reagentes e produtos. A variação de entalpia de uma reação (∆H) é obtida pela diferença entre o somatório dos calores de formação dos produtos da reação e o somatório dos calores de formação dos reagentes: ∆Hfo = Σ n∆ ∆Hfo(produtos) - Σ m∆ ∆Hfo(reagentes) O símbolo Σ (sigma) significa “ o somatório de “ e “n” e “m” são os coeficientes estequiométricos da equação química. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Figura 6: Entalpia padrão de formação. 7 Energia de Ligação É a energia que é fornecida para romper 1 mol de ligações entre dois átomos em um sistema gasoso a 25 oC e 1 atm. Reagentes: processo endotérmico – quebra de uma ligação química Produtos: processo exotérmico – formação de uma ligação química. Figura 7: Ilustração da energia de ligação Exemplo: Qual a variação de entalpia da reação H2(g) + Cl2(g) 2HCl(g), conhecendo as seguintes energias de ligação? H-H = 104,2 kJ/mol; Cl-Cl = 57,9 kJ/mol; H-Cl = 103,1 kJ/mol ∆H da reação = energia das ligações rompidas – energia das ligações formadas ∆H da reação = 104,2 + 57,9 – 2(103,1) ∆H da reação = -44,1 kJ Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Figura 8: Energias de ligação de algumas substâncias. Vejamos um outro exemplo contendo o diagrama de entalpia para a combustão do gás propano. Figura 9: Diagrama de entalpia de combustão do gás propano. 8 Alimentos e Combustíveis A maioria das reações químicas utilizadas para a produção de calor são de combustão. A energia liberada quando 1 g de uma substância sofre combustão é normalmente chamada de calor de calor especifico de combustão. Como o calor especifico de combustão representa o calor liberado em uma combustão, ele é um número positivo. O calor especifico de combustão de qualquer alimento ou combustível pode ser medido pela calorimetria. 8.1 Alimentos Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 A maior parte da energia de nosso corpo necessita vem de carboidratos e gorduras. As formas de carboidratos conhecidos como amido são decompostos no intestino em glicose C6H12O6. A glicose é solúvel no sangue, e no corpo humano é conhecida por açúcar no sangue. Ela é transportada pelo sangue para as células, onde reage com o O2 em uma série de etapas, produzindo CO2(g), H2O(l) e energia. C6H12O6(s) + 6O2(g) -> 6CO2(g)+ 6H2O(l), ∆H = -2803 kJ A decomposição dos carboidratos é rápida, portanto sua energia é fornecida rapidamente ao corpo. No entanto, o corpo armazena apenas uma quantidade muito pequena de carboidratos. O valor específico de combustão médio dos carboidratos é 17 KJ. O corpo utiliza a energia química dos alimentos para manter a temperatura corporal, para contrair os músculos e para contrair e reparar os tecidos. Qualquer excesso de energia é armazenado na forma de gorduras. As gorduras são bem apropriadas para servirem como reserva de energia do corpo por no mínimo duas razões: (1) são insolúveis em água, o que facilita o armazenamento no corpo, e (2) produzem mais energia por grama do que proteínas ou carboidratos, o que os torna fontes de energia eficientes em termos de massa. O calor específico médio de combustão das gorduras é de 38 KJ/g. O metabolismo de proteínas no corpo produz menos energia que a combustão em um calorímetro por que os produtos são diferentes. Proteínas contém N2, o qual na bomba calorimétrica é liberado como N2. No corpo esse N2 vira principalmente uréia (NH2)2 CO. As proteínas são utilizadas pelo corpo principalmente como materiais para a produção de tecidos de órgãos, pele, cabelo, músculo, e assim por diante. 8.2 Combustíveis Durante a combustão completa de um combustível, o carbono é convertido em CO2 e o H2, em H2O, tendo ambos grandes entalpias de formação negativas. Consequentemente, quanto maior a porcentagem de carbono e hidrogênio num combustível, mais alto é seu calor especifico de combustão. O carvão, o petróleo e o gás natural, principais fontes de energia são conhecidos como combustíveis fósseis. O gás natural consiste de hidrocarbonetos gasosos, compostos de hidrogênio e carbono. Ele contém CH4, C2H6, C3H8 e C4H10. O petróleo é um líquido composto de milhares de compostos. A maior parte deles são hidrocarbonetos, e o restante são principalmente compostos orgânicos contendo S, N ou O2. O carvão que é solido, contém hidrocarbonetos de alto peso molecular, bem como compostos contendo enxofre, O2 ou N2. O carvão é o combustível fóssil mais abundante, ele compreende 90% das reservas mundiais. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 8.3 Outras fontes de energia Fontes de energia renovável, incluem energia solar, energia eólica, energia geotérmica, energia hidroelétrica e energia de biomassa. Energia solar aproveitada através de painéis solares Energia eólica aproveitadas através de moinhos de vento Energia geotérmica aproveitada a partir da energia do centro da terra Energia hidroelétrica das correntes dos rios Energia de biomassa de colheitas, como árvores e milho e de matéria biológica residual Figura 10: Fontes de energias consumidas nos EUA. Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000 Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil, 57160-000
Download