UNIVERSIDADE FEDERAL FLUMINENSE DISCIPLINA MICROBIOLOGIA GERAL ROTEIRO DE AULAS PRÁTICAS 2 NORMAS PARA OS TRABALHOS NO LABORATÓRIO DE MICROBIOLOGIA • O avental ( ou jaleco ) é de uso obrigatório. Não será permitida a entrada do aluno no laboratório em horário de aula ou fora dela sem o mesmo. • O laboratório deve ser um recinto calmo, os alunos devem evitar conversar e sair de seus lugares desnecessariamente. • Em caso de algum acidente, comunicar imediatamente ao professor. No caso de quebra, durante a manipulação com tubos ou placas contendo meios contaminados, não remover os fragmentos quebrados, deixando-os no local. Na ausência do professor, verter sobre estes formol, avisando o professor ou monitor o horário do acontecido para após transcorrido o tempo necessário para que o formol mate os microrganismos, o material seja removido e o local devidamente limpo. • Sempre lavar as mãos com água e sabão antes e após terminar o trabalho prático. • Não fumar, não comer e nem levar à boca qualquer objeto. No laboratório de microbiologia trabalha-se com microrganismos potencialmente patogênicos, devendo-se ter sempre cuidado para evitar uma possível contaminação ( a boca é porta de entrada para muitas infecções ). • Na bancada de trabalho não deve haver acúmulo de objetos, nela permanecendo apenas os indispensáveis para o experimento em execução, além do roteiro e caneta ou lápis para as devidas anotações. Todo material do aluno deverá ficar nas estantes que se encontram nos laboratórios. • Durante os trabalhos, manter o bico de gás aceso somente quando necessário. • As alças e agulhas de platina, pinças, estiletes, cotonetes, tubos contendo os meios de cultura, reagentes e corantes, etc., devem ser colocados nos suportes apropriados e não abandonados sobre a bancada de trabalho. • As pipetas usadas, lâminas e lamínulas (quando for o caso), etc., devem ser colocados em recipientes apropriados contendo solução desinfetante ou detergente. • Todo o material utilizado nos experimentos, como por exemplo as placas de Petri e os tubos de ensaio contendo meios de cultura ou soluções, deverão ser devidamente identificados para observações posteriores. (Estes devem conter: disciplina, data, curso, equipe, microrganismo ou material utilizado) • Antes de qualquer observação microscópica, devem ser verificadas as condições em que se encontra o microscópio. • Após o uso do microscópio, desligar a lâmpada, retirar a lâmina usada e quando for o caso, dispensá-la na cuba apropriada. Limpar as objetivas com algodão embebido em xilol ou benzina e depois com um algodão seco ou flanela. • Terminado o trabalho prático, deixar a bancada em ordem. • O material contaminado nunca deve ser colocado na bancada, pia ou lixo. Deve voltar ao recipiente de onde foi tirado para ser esterilizado. OBS: Cada aula prática deverá iniciar-se com uma explicação e um período de demonstração. O trabalho não deve ser iniciado pelo aluno, até que haja recebido todas as instruções necessárias. Os alunos deverão adquirir para seu uso individual o seguinte material, que deverá acompanhá-lo impreterivelmente em todas as aulas práticas: ♦ Isqueiro ou caixa de fósforos. ♦ Caneta para retroprojetor azul ou preta ( para identificação do material ). ♦ Pinça inoxidável. 3 INTRODUÇÃO AO CURSO PRÁTICO DE MICROBIOLOGIA Na natureza os microrganismos encontram-se formando populações mistas (vários tipos de microrganismos que pertencem a um mesmo habitat). Por outro lado, o desenvolvimento da microbiologia assim como todos os procedimentos laboratoriais para o diagnóstico, dependem da obtenção do crescimento dos microrganismos na forma de populações puras , que quando crescidas em meios de cultura denominamse culturas puras ou axênicas ( populações homogêneas quanto ao tipo de microrganismo, cultivados em meios de cultura sem a presença de outras formas de vida contaminantes ). A obtenção de uma cultura pura a partir de uma cultura mista denomina-se isolamento, conseguido através da semeadura dos microrganismos na superfície de meios de cultura sólidos em placas de Petri, o que permitirá a formação de colônias ( que são populações isoladas que crescem na superfície destes meios). Como todos os seres vivos, os microrganismos necessitam de nutrientes apropriados ao seu desenvolvimento, assim como condições físicas ou ambientais favoráveis. Quando cultivados em laboratório, estas necessidades devem ser respeitadas. O meio de cultura, portanto, deve conter: nutrientes em concentrações adequados ao crescimento do microrganismo que desejamos cultivar, além das condições ambientais requeridas como: pH ideal, adequado ao seu crescimento, aeração, umidade, pressão osmótica, temperatura, etc. Os meios de cultura são utilizados em três diferentes tipos de consistência: sob a forma líquida (denominados de meios líquidos ou caldos), sólida (denominados de meios sólidos ou solidificados, obtidos pela adição de agar-agar ao meio) e eventualmente semi-sólida (denominados de meios semi-sólidos, obtidos pela adição de pequena quantidade de agar-agar ao meio ). Conforme já dito, o estudo dos microrganismos (fungos e bactérias) , depende da obtenção de uma grande quantidade de microrganismos idênticos ( cultura pura ), que são obtidos em laboratório através do isolamento a partir de uma população mista. Para isto devemos preparar meios de cultura estéreis e conservá-los em condições estéreis (desprovidos de qualquer forma de vida). Ao introduzimos no meio estéril o inóculo (quando estaremos semeando, inoculando), teremos o cuidado técnico necessário para que não haja contaminação externa (ambiental). Este procedimento denomina-se técnica asséptica. Depois de inoculado, o meio de cultura contendo os microrganismos é incubado (colocado para crescer) em local apropriado e se for o caso, em local cuja temperatura seja controlada ( por exemplo : a estufa ). O crescimento significará o desenvolvimento de uma população a partir de uma ou algumas células. Este poderá ser evidenciado a olho nú, sob a forma de turvação (em meio líquido ) ou formação de colônias quando em meio sólido. 4 PRINCÍPIOS BÁSICOS DE MICROSCOPIA ÓPTICA Constituição Do M.O.C. Atualmente, o microscópio óptico composto (M.O.C.) é constituído por duas partes – uma parte mecânica e uma parte óptica. Cada parte engloba uma série de componentes constituintes do microscópio (fig. 1). Ocular Tubo Revólver Objetiva Coluna Platina Diafragma Condensador Fonte de luz Pé Parafuso Micrométrico Parafuso Macrométrico A parte mecânica serve para dar estabilidade e suportar a parte óptica. Esta parte é constituída por: Pé ou Base – suporta o microscópio, assegurando a sua estabilidade. Braço ou Coluna – peça fixa à base, na qual estão aplicadas todas as outras partes constituintes do microscópio. Tubo ou Canhão – cilindro que suporta os sistemas de lentes, localizando-se na extremidade superior a ocular e na inferior o revólver com objectivas. Platina – peça circular, quadrada ou retangular, paralela à base, onde se coloca a preparação a observar, possuindo no centro um orifício circular ou alongado que possibilita a passagem dos raios luminosos concentrados pelo condensador. 5 Parafuso Macrométrico – engrenagem que suporta o tubo e permite a sua deslocação a da platina. É indispensável para fazer a focagem. Parafuso Micrométrico – imprime ao tubo ou à platina movimentos de amplitude muito reduzida, completando a focagem. Permite explorar a profundidade de campo do microscópio. Revólver – disco adaptado à zona inferior do tubo, que suporta duas a quatro objetivas de diferentes ampliações: por rotação é possível trocar rápida e comodamente de objectiva. A parte óptica é constituída por: Sistema de Oculares e Sistema de Objetivas – o conjunto de lentes que permitem a ampliação do objeto. A ampliação dada ao microscópio é igual ao produto da ampliação da objetiva pela ampliação da ocular. Fonte Luminosa – existem vários tipos de fontes luminosas, podendo ser uma lâmpada (iluminação artificial), ou um espelho que reflita a luz solar (iluminação natural). Condensador – distribui regularmente, no campo visual do microscópio, a luz refletida pelo espelho. Diafragma – regula a intensidade luminosa no campo visual do microscópio. Devido a estes componentes serem de alta precisão e porque o microscópio é um instrumento caro, requer cuidados especiais de transporte, utilização e manutenção. Posição do Observador - O observador deve estar sentado. - Se o M.O.C. possuir uma ocular, deve olhar por ela com o olho esquerdo, mantendo os dois olhos abertos. Se o M.O.C. tiver duas oculares, deve olhar por ambas. - Os parafusos de comando devem ser manuseados com a mão esquerda, deixando a mão direita livre para desenhar as observações. Focalização - Colocar a ocular desejada; - Acender a fonte de luz acoplada; 6 - Posicionar o condensador o mais próximo possível da platina; - Verificar se o diafragma está completamente aberto; - Colocar em foco a objetiva de menor aumento; - Fixar a lâmina preparada para observação na platina, através das presilhas; - Observar o campo microscópico; - Ajustar o foco utilizando o parafuso macrométrico. - Para maior aumento trocar as objetivas e ajustando o foco com o parafuso macrométrico e se necessário o micrométrico; - Para observar a lâmina corada com a objetiva de imersão, colocar uma gota de óleo de cedro sobre a área corada da lâmina; - Girar o revolver colocando a objetiva de imersão (maior aumento) em foco; - Olhando pelo lado, descer o canhão (ou subir a mesa de platina) utilizando o parafuso macrométrico até que a lente da objetiva de imersão encoste no óleo de cedro. NUNCA focalizar a imagem pela objetiva de imersão olhando pela ocular e sim sempre pelo lado; - Olhando pela ocular, girar o parafuso macrométrico LENTAMENTE, até conseguir focalizar de formar grosseira a preparação; - Mover o parafuso micrométrico até conseguir uma focalização ideal; - Para mudar o campo microscópico a ser observado, mover o charriot ; Cuidados a ter com o M.O.C. - Deve-se pegar no M.O.C. pelo braço, com a mão direita, enquanto se suporta a base com a mão esquerda; - Não se deve tocar no sistema óptico com os dedos; - A lente das objetivas não deve tocar na lamela; - O M.O.C. deve estar completamente pousado numa mesa desocupado, e afastado da borda da mesa. 7 Material Necessário Lâminas coradas pelo método de Gram com as seguintes bactérias: A) Staphylococcus sp B) Streptococcus sp C) Escherichia coli D) Bacillus sp Microscópio óptico Óleo de imersão (cedro) Papel absorvente, limpar lentes após o uso Objetivos da aula A) Conhecer o microscópio óptico e suas partes B) Manusear o microscópio óptico com os devidos cuidados C) Observar morfologia bacteriana utilizando o microscópio optico A) B) C) D) 8 B) COLORAÇÃO DE BACTÉRIAS As bactérias podem ser observadas de duas maneiras: com e sem coloração. 1- Sem coloração: os microrganismos são observados vivos, podendo ser evidenciada a motilidade. 2- Com coloração: os microrganismos são corados após serem mortos. Apesar de quimicamente distintas do meio que as rodeiam, as bactérias são quase incolores não apresentando contraste suficiente com o meio em que se encontram, o que dificulta sua visualização. A diferença química entre as bactérias e o meio é que nos permite distinguí-las por meio de coloração, pois o corante não reage com o meio externo, tornando-as quando coradas, mais visíveis ao microscópio. Desta maneira poderemos observar suas formas fundamentais, dimensões e arranjos. A coloração apresenta ainda outras vantagens, pois com a utilização da objetiva de imersão teremos uma maior amplificação da imagem, além de nos permitir o estudo de estruturas da célula bacteriana como: parede celular, endosporos, flagelos e cápsula. As bactérias coram-se com os derivados de anilina (azul de metileno, fucsina,cristal, violeta, etc..) que são corantes básicos ( íon colorido = cátion ) e que possuem afinidade pelo citoplasma destas células. Esta afinidade se deve ao fato do citoplasma bacteriano apresentar carga elétrica negativa, derivada, principalmente, dos radicais fosfatos dos ácidos nucléicos que aí se encontram. São dois os processos que nos permitem corar as bactérias: COLORAÇÃO SIMPLES: Nesta coloração utilizamos apenas um corante e ela baseia-se na diferença química existente entre as bactérias e o meio. Uma vez coradas, apresentam contraste, podendo ser melhor visualizadas. COLORAÇÃO DIFERENCIAL: Nesta coloração utilizamos geralmente 2 corantes, além do mordente e do diferenciador. Baseia-se na diferença química existente entre as bactérias e consequentemente na reação diferente que as bactérias podem apresentar frente a um determinado corante. É utilizada para distinguir diferentes tipos de bactérias. Os métodos de Gram (1884) e de Ziehl-Neelsen (1882) são exemplos de coloração diferencial. PREPARAÇÃO DO ESFREGAÇO E FIXAÇÃO DA AMOSTRA PARA COLORAÇÃO: Marcar com lápis dermográfico o lado da lâmina onde realizaremos o esfregaço e colocar sobre ela o material contendo os microrganismos. Estes poderão ser provenientes de: água, solo, alimentos, medicamentos, lesão, sangue, urina, líquor, fezes, escarro, secreção uretral, etc. No caso do material ser obtido a partir de meio de cultura sólido ou de outro que contenha microrganismos em excesso, deve-se diluí- 9 lo com uma gota de água destilada ou salina estéril (colocada anteriormente sobre a lâmina com auxílio de uma alça de platina estéril) até obter-se uma leve opalescência. Espalhar com movimentos circulares até formar uma fina camada sobre a lâmina. Deixar a lâmina secar ao ar, em repouso. A secagem ao ar evita a formação de aerossóis que acontecem quando fixamos a lâmina antes que a mesma esteja seca. Os aerossóis se constituem de fonte de contaminação, pois nestes estão contidos os microrganismos presentes no material. Após seca, a lâmina deverá ser fixada, antes de iniciarmos o processo de coloração. A fixação evita que as células dos microrganismos sejam lavadas e perdidas durante o processo de coloração. Além disto, a fixação permite a aderência das células à lâmina, matando os microrganismos através da coagulação seus protoplasmas, preservando suas estruturas na forma e posição originais. O calor é o método de fixação freqüentemente utilizado. Para fixarmos, passamos a lâmina com o esfregaço voltado para cima, por três vezes através da chama. Evitar o super aquecimento testando a cada passada a temperatura da lâmina no dorso da mão. COLORAÇÃO PELO MÉTODO DE GRAM É o método de coloração mais empregado em bacteriologia. Importância do método: . separa as bactérias em dois grandes grupos: GRAM POSITIVAS (G+/GP) e GRAM NEGATIVAS (G- /GN); . taxonomia ( identificação, classificação e nomenclatura, sendo o primeiro passo no processo de identificação); . possibilita o diagnóstico presuntivo (preliminar), principalmente em casos de infecções graves e de evolução fatal quando o médico necessita introduzir uma terapêutica, antes mesmo da identificação do microrganismo causador da infecção ; . permite evidenciarmos a contaminação a partir de diferentes materiais. SOLUÇÕES EMPREGADAS: 1- CRISTAL VIOLETA - função: corante principal ( cora igualmente todas as bactérias ) 2- LUGOL ( solução de iodo-iodeto de potássio) - função: mordente. O mordente tem a finalidade de aumentar a afinidade do corante pela célula, permitindo que ela se core mais intensamente. 3- ÁLCOOL ETÍLICO - função: agente descorante e diferenciador. Sua utilização permite que algumas células se descorem mais facilmente que outras. Este comportamento distinto de descoloração é que diferencia as bactérias. 4-- FUCSINA DILUÍDA - função: corante de contraste, corante secundário ou contracorante. É o corante que dá às células descoradas uma cor diferente daquelas que mantêm a cor do corante principal. 10 Os microrganismos que não se descoram facilmente retêm a cor do corante principal ( cristal violeta ) enquanto que aqueles que se descoram facilmente poderão ser visualizados, pois corar-se-ão com o corante de contraste ( fucsina. ). TÉCNICA: 1º- Cobrir o esfregaço já fixado com solução de Cristal Violeta por um (1) minuto. 2º-Escorrer o cristal violeta, lavar em fio d’água e cobrir o esfregaço com Lugol por um (1) minuto. 3º-Escorrer o lugol, lavar em fio d’água . 4º- Descorar rapidamente com Álcool Etílico ( +/- 20 segundos) 5º-Interromper o processo de descoramento lavando o esfregaço com fio d’ água. 6º-Cobrir o esfregaço com Fucsina diluída por 30 segundos. 7º-Lavar e secar com papel filtro, pressionando o esfregaço cuidadosamente. 8º-Colocar uma gota de óleo de imersão sobre o esfregaço e observar ao microscópio, utilizando a objetiva de imersão. RESULTADO: Bactérias coradas em roxo ( cor do cristal violeta ) - GRAM POSITIVAS Bactérias coradas em vermelho ( cor da fucsina ) - GRAM NEGATIVAS FUNDAMENTO DA TÉCNICA DE GRAM: Muitas explicações já foram sugeridas na tentativa de elucidar o mecanismo da reação de Gram. As mais plausíveis dizem respeito à diferença na estrutura química da parede celular. Num primeiro momento, todas as bactérias ( G+ e G- ) absorvem igualmente o cristal violeta ( corante básico que possui afinidade pelos seus citoplasmas, devido a carga elétrica negativa oriunda principalmente dos radicais fosfatos dos ácidos nucléicos ). A seguir, o lugol reage com o cristal violeta formando o complexo iodo-pararosanilina, que se fixa e cora a célula mais intensamente. Posteriormente, quando tratamos o esfregaço com álcool, as bactérias se comportam de maneira diferente: -1) as Gram-positivas não se descoram facilmente pelo tratamento com o álcool. Isto se explica pelo fato de comporem sua parede celular uma espessa camada de peptideoglicano, além de outros possíveis componentes, como: ác. teicóicos, proteínas. polissacárides e etc., substâncias estas, não solúveis em álcool. O álcool atua desidratando as várias camadas desta parede, o que traz como conseqüência uma diminuição na sua porosidade e esta diminuição reduziria a permeabilidade da parede, dificultando a extração (saída) do complexo CV-I ( que se encontra no citoplasma ) de dentro da célula. Além disto, parece haver uma retenção do CV-I na parede após a ação do álcool, o que também contribuiria para a diminuição de sua porosidade. A bactéria Gram-positiva permanece então com a mesma coloração até o final. -2) as bactérias Gram-negativas são descoradas pelo tratamento com o álcool. Tal fato se explica por comporem a parede destas bactérias: delgada camada de peptideoglicano (menor entrecruzamento, o que não é suficiente para impedir a passagem do solvente ) além de substâncias ricas em lípides (lipoproteina de apoio, fosfolípides da membrana externa e lipídio “A” que participa do LPS). O álcool solubiliza (dissolve) estes lípideos (muitas vezes extraindo a camada da membrana externa), aumentando a porosidade da parede, o que contribuiria para um aumento da permeabilidade. Assim sendo, o álcool penetra dentro da célula (atravessando a membrana citoplasmática), removendo o complexo CV-I, descorando a célula. Finalmente as bactérias descoradas pelo álcool, por não apresentarem contraste que permita sua visualização, seriam coradas pelo corante secundário que é a fucsina. As células que não foram descoradas pelo álcool (e tiveram sua permeabilidade diminuída) permaneceriam coradas com a cor do corante principal até o final da coloração, pois não absorveriam a fucsina. 11 CONTROLE DAS POPULAÇÕES MICROBIANAS IMPORTÂNCIA : a)Prevenir transmissão de doenças. b)Prevenir a contaminação ou crescimento de microrganismos nocivos. c)Prevenir a deterioração e danos de materiais pelos microrganismos. OBJETIVOS: remoção, inibição ou morte dos microrganismos através da ação de agentes físicos e químicos. OS AGENTES FÍSICOS E QUÍMICOS PODEM PROMOVER: • Esterilização: destruição de todas as formas de vida (células vegetativas e esporos ). • Desinfecção: destruição das formas vegetativas dos microrganismos (patogênicos e inócuos), mas não necessariamente das formas esporuladas. Geralmente refere-se a substâncias químicas ( desinfetantes ) aplicadas sobre objetos inanimados. • Anti-sepsia: processo permite a remoção de parte dos microrganismos presentes em tecidos vivos. Associado a substâncias químicas ( anti-sépticos ) aplicadas sobre estes tecidos. • Esporocida: agente físico ou químico que mata as formas esporuladas dos microrganismos. • Assepsia: conjunto de técnicas utilizados para impedir a penetração de germes em locais que não os contenha. CONDIÇÕES QUE AFETAM A AÇÃO ANTIMICROBIANA DOS AGENTES FÍSICOS E QUÍMICOS 1. Relacionadas ao microrganismo: - tipo: forma vegetativa (mais susceptível), forma esporulada (mais resistente). - estado fisiológico das células: células jovens (mais susceptíveis), células velhas ( mais resistentes, que por poderem apresentar alterações fisiológicas e/ou estruturais, tornam-se mais resistentes ). - nº de microrganismos: quanto maior o número de microrganismos presentes num material, maior a chance de haver sobreviventes e formas resistentes. 2. Relacionadas ao ambiente ou material onde se encontram os microrganismos: - pH: o calor é mais eficiente em pH ácido. - temperatura: quanto maior, maior a probabilidade de eliminação. - presença de compostos orgânicos: protegem os microrganismos, diminuindo a ação de alguns agentes químicos. - consistência do material: aquoso (maior penetração), viscoso, denso (menor penetração) 3. Tempo: os processos não são instantâneos. 12 AGENTES FÍSICOS UTILIZADOS NO CONTROLE DOS MICRORGANISMOS CALOR: a) Calor Seco: 1- Forno de Pasteur (forno de ar quente): ação esterilizante (causa a morte por promover: a oxidação das proteínas que constituem o microrganismo). - Condições de esterilização: de 150 a 170° C, de 1 a 2 horas - Utilização: esterilização de substâncias imiscíveis em água (como pós, óleos etc.), instrumentos cortantes (tesouras, bisturis, agulhas hipodérmicas e etc.) e vidrarias limpas e secas (placas de Petri, seringas de vidro, pipetas, balões, tubos de ensaio). 2- Incineração: ação esterilizante. Leva à carbonização do material e dos microrganismos. - Para descartáveis: animais usados em experimentos e produtos contaminados (cotonetes, curativos e ataduras contaminados, seringas plásticas contaminadas e etc.). 3- Flambagem: ação esterilizante: carbonização do microrganismo. - O material é submetido a ação direta da chama. - Condições de esterilização: 200 a 300ºC, por poucos segundos. - Uso: apenas na rotina microbiológica (alças e agulhas de platina, estiletes, bocas dos tubos). b) Calor Úmido: 1- Autoclavação: realizada em autoclaves (aparelhos que utilizam vapor saturado sob pressão). Ação esterilizante. Causa a morte por promover a desnaturação das proteínas que constituem os microrganismos. - Condições para esterilização: 121° C por 15 a 30 minutos a 1 atmosfera a mais de pressão. - Substâncias miscíveis com água (meios de cultura, solução salina, água, etc.), cotonetes, luvas de látex (cirúrgica), sondas, cateteres, gaze, rouparia, material contaminado, etc. OBS: utilizada apenas em materiais que não se alteram com a temperatura. 2- Ebulição: água à temperatura de 100°C por um tempo de 30 minutos. Causa desnaturação protéica, eliminando apenas formas vegetativas. 3- Pasteurização: processo utilizado para alimentos. Elimina apenas microrganismos patogênicos: Salmonella typhi, Brucella abortus e etc. - Condições: 63°C por 30 minutos ou 72°C por 15 segundos, seguido de resfriamento rápido (leite e vinho). UHT: leite aquecido a 74°C, em seguida aquecido a 140°C (5 segundos) e resfriamento imediato. 13 4- Vapor Fluente Fracionado - Tyndalização : submeter ao vapor fluente contínuo por 3 vezes, com intervalo de 12 a 18 horas após cada execução, tomando-se o cuidado de não abrir o recipiente onde está acondicionado o material. Elimina formas vegetativas e esporuladas. Causa a morte por promover a desnaturação de proteínas dos microrganismos. - Uso: soluções (vitaminas, carboidratos) e materiais que não suportam temperaturas acima de 100ºC. c) Radiações: o tempo e a intensidade das radiações depende do material a ser esterilizado. 1- Radiações Não Ionizantes - raios Ultra-Violeta: baixo poder de penetração: λ longo (carreia menos energia). Utilizado apenas em superfícies. Causam danos ao DNA levando a formação de dímeros de pirimidina (mutação). - Utilizado: eliminação de microrganismos em superfícies. 2- Radiações Ionizantes - raios X e raios Gama : alta penetrabilidade. λ curto (muita energia). Promovem a excitação de elétrons, formando radicais altamente reativos (OH-, H+, H2O2 ). - Esterilização de fios de sutura, material biológico (soros, antibióticos e vacinas) que não podem ser submetidos à ação do calor. d) Microondas: muito empregado em laboratórios. As radiações emitidas não afetam diretamente os microrganismos, mas geram calor, que é o responsável pela morte dos microrganismos. Ainda não existem trabalhos mostrando tempo e potência. e) Filtração: fazem desinfecção e não esterilização. Apresentam poros de diferentes diâmetros. Ex.: Membranas Filtrantes - Millipore: éster de celulose (remove bactérias e alguns vírus) AGENTES QUÍMICOS UTILIZADOS NO CONTROLE DOS MICRORGANISMOS. a) Álcoois: anti-sépticos ou desinfetantes. Atua sobre formas vegetativas promovendo a desnaturação de proteínas. É mais eficiente à 70%, pois as proteínas celulares são mais facilmente desnaturadas na presença da água. b) Aldeídos e derivados: atua alquilando grupamentos funcionais das proteínas como aminas, carboxilas e hidroxilas, formando hidroximetilderivados inativos. Mais empregados: aldeído fórmico (concentração: 3 - 8%) e aldeído glutárico a 2%. 14 c) Fenóis e derivados: Atua sobre proteínas a uma concentração de 0.2 a 1%. Bastante tóxico. Mais empregados: cresóis (metacresol é um dos isômeros mais ativos). A creolina (mistura de cresóis) é utilizada na desinfecção de pisos, vasos sanitários, excrementos, etc. d) Halogênios e derivados: o iodo é o mais empregado. Atua como bactericiada, fungicida e esporocida, combinando-se irreversivelmente com proteínas, através de interação com aminoácidos aromáticos (fenilalanina e tirosina). As soluções alcoólicas contendo 2% de iodo exercem ação imediata. Cloro: ataca grupamentos aminados das proteínas, formando cloroaminoácidos inativos. Utilizado sob a forma: hipoclorito de sódio ou cálcio, ácido hipocloroso. e) Agentes de superfície: detergentes catiônicos: utilizados em desinfecção e anti-sepsias. Mais empregados são: cloreto de benzalcônio, cloreto benzetônio e cloreto de cetilpiridínico. Clorexidina: empregada na anti-sepsia da pele, em anti-sépticos bucais, etc. f) Esterilizantes gasosos: óxido de etileno: utilizado na esterilização de instrumentos cirúrgicos, fios de sutura, etc. Atua promovendo a alquilação direta dos grupamentos carboxila, hidroxilas e sulfidrilas, inativando certas enzimas. INDICADORES DE ESTERILIZAÇÃO: - Substâncias com ponto de fusão conhecidos :Ácido Benzóico (121°C) e Uréia (125°C). - Cultura de microrganismos esporulado: Bacillus stearothermophilus - Fitas indicadoras de esterilização. 15 ANTISSEPSIA DA PELE Várias substâncias químicas são utilizadas no processo de anti-sepsia da pele. Dentre estas, encontramos o iodo, álcool, triclosan e clorexidina como uma das mais utilizadas. O iodo é um halogênio que exibe sua ação sobre os microrganismos através de diferentes mecanismos de ação quais sejam: promovendo inativação enzimática ou como oxidante, causando assim sua morte, Atua como bactericiada, fungicida e esporocida, combinando-se irreversivelmente com proteínas, através de interação com aminoácidos aromáticos (fenilalanina e tirosina). As soluções alcoólicas contendo 2% de iodo exercem ação imediata. Os Álcoois: anti-sépticos ou desinfetantes. Atua sobre formas vegetativas promovendo a precipitação e desnaturação de proteínas. É mais eficiente à 70%, pois as proteínas celulares são mais facilmente desnaturadas na presença da água. O gluconato de clorexidina é um Anti-séptico químico, Antifúngico e um bactericida capaz de eliminar tanto bactérias gram-positivas quanto as gram-negativas, no entanto mostra-se menos eficiente com os microrganismos gram-negativos. Também é um bacteriostático, impedindo a proliferação de bactérias. Acredita-se que o mecanismo de ação ocorra através da ruptura da membrana celular, e não pela inativação por ATPase como pensava-se anteriormente. Gluconato de clorexidina Triclosan ou triclosano é um agente anti-séptico efetivo contra bactérias gram negativas, bem como gram positivas. É eficaz também contra fungos e bolores. É encontrado em medicamentos, sabonetes, loções e cremes dentais. Apresenta boa tolerância para uso na pele e cavidade bucal em baixas concentrações. Triclosan OBJETIVO: utilizar uma solução de iodo, álcool, triclosan e clorexidina sobre uma porção da pele com a finalidade de reduzir a microbiota , eliminando quase todos os microrganismos presentes. 16 TÉCNICA: Dividir o fundo da parte externa da placa como auxílio de uma caneta de retroprojetor, escrevendo de um lado “ salina “ e do outro “ iodo, álcool, triclosan ou clorexidina “. Depois proceder como segue: 1º: molhar o cotonete em solução fisiológica ( salina ) e esfregá-lo no dorso de uma das mãos, em uma área de + ou - 4 cm ( girando sempre o cotonete ). 2º: Semear com este cotonete a metade da placa, no lado correspondente à “salina.” 3º: Com a outra extremidade da haste ( não utilizada ) deste mesmo cotonete, embebê-la na solução de iodo e esfregá-la sobre o dorso da outra mão em área de + ou _4 cm. AGUARDAR 5 ( CINCO ) MINUTOS PARA QUE O IODO POSSA ATUAR SOBRE OS MICRORGANISMOS DA PELE, ELIMINANDO-OS. 4º: Pegar o outro cotonete e molhá-lo em solução fisiológica, esfregando-o sobre a área onde foi passada a solução de iodo, álcool, triclosan ou clorexidina. 5º: Semear com este cotonete a outra metade da placa, no lado correspondente ao “iodo, iodo álcool, triclosan ou clorexidina”. 6º: Levar a placa identificada para ser incubada na estufa a 37ºC por 24 horas. Após esse prazo retornar ao laboratório para complementar seu experimento, conforme instruções abaixo. Fazer leitura da placa após 24 horas de incubação, concluir o resultado e realizar um Gram das diferentes colônias crescidas dos dois lados da placa, descrevendo o observado. 17 MEIOS DE CULTURA OBJETIVO: Técnica para a execução dos meios de cultura; tipos de meios empregados para o isolamento e identificação de microrganismos ( bactérias e fungos ). MEIO DE CULTURA: Os microrganismos possuem um ciclo natural na água, solo, ar, na nossa superfície corporal e de outros animais etc. Estes microrganismos conseguem sobreviver à custa de materiais orgânicos e inorgânicos existentes nestes ambientes. O ciclo artificial (meio de cultura) é o modo que empregamos em laboratório para cultivarmos os microrganismos. Chamamos de meio de cultura ao conjunto de substâncias necessárias ao crescimento e multiplicação dos microrganismos No ciclo artificial tentamos reproduzir as condições naturais fornecendo: A - Substâncias nutritivas em concentrações adequadas, que devem servir como: - fonte de energia - fonte de nitrogênio - fonte de carbono - fonte de sais e íons - fonte de enxofre e fósforo - fatores de crescimento - doador de elétrons - receptor de elétrons B - Condições ambientais favoráveis: - temperatura (termófilos, mesófilos e psicrófilos) - umidade - pH ( de 2 a 9 ) - atmosfera de incubação (aerobiose, microaerofilia, anaerobiose) Técnicas para a execução dos meios de cultura: 1- Usar somente substâncias químicas ou ingredientes de boa qualidade 2- Fazer a pesagem corretamente 3- Usar vidraria seca e limpa 4- Usar apenas os ingredientes da fórmula 5- Se necessário, filtrar 6- Ajustar o pH do meio após a filtração, antes de juntar o agar 7-Para manter a eficiência dos meios depois de prontos, conservá-los em lugar frio, escuro e em recipientes herméticamente fechados. Estado físico (consistência): Os meios podem ser classificados em: 1- Líquidos: utilizados para crescimento em massa ( não promovem a formação de colônias, mas sim, crescimento por dispersão ). 2- Semi-sólidos: para verificação de motilidade (0,5% de agar-agar) 3- Sólidos: para fazer isolamento, devido a formação de colônias (1,5 % a 2% de agar-agar) 18 Finalidade: - Meios de enriquecimento: aumentam a possibilidade de crescimento da espécie desejada, quando a mesma se encontra em pequeno número. - Meios indicadores (ou diferenciais): revelam uma propriedade bioquímica, permitindo uma identificação presuntiva. - Meios seletivos: impedem o crescimento de determinados grupos num inóculo misto, mas permite o desenvolvimento de outros. - Meios seletivos-indicadores: revelam uma propriedade bioquímica e selecionam grupos de bactérias. - Meios de triagem: empregados para separar bactérias da mesma família. - Meios de transporte: garantem por mais tempo a viabilidade dos microrganismos que não podem ser semeados logo após a coleta e que poderiam morrer. Componentes básicos dos meios de cultura: - Extratos: de carne e de levedura. Concentrados aquosos desidratados que servem como fonte de: carboidratos, vitaminas, compostos orgânicos nitrogenados e sais. - Peptonas: derivados da hidrólise ácida ou enzimática de proteínas de origem animal ou vegetal (peptona de caseína, peptona de soja) que servem como fonte de N orgânico, vitaminas, carboidratos, enxofre, fósforo, cálcio e magnésio. - Agar-agar: polissacarídeo obtido a partir de algas rodofíceas. Função: agente solidificante, cujo P.F.= 95° C e o P.S.= 45° C. Não tem função nutritiva. - NaCl: mantém o equilíbrio osmótico do meio e serve como fonte dos íons Na e Cl. - Água: umidade e fontes de íons. Fórmulas de alguns meios básicos, de uso rotineiro em bacteriologia: CALDO SIMPLES: AGAR SIMPLES: - Extrato de carne - 5 g - Caldo simples ( com pH aferido ) - 1000 ml - Peptona - 10 g - Ágar-agar - 20 g - NaCl - 5 g - H2O - 1000 ml Modo de preparo: Fundir a mistura acima em banho-maria, - pH: 7,4 +/- 0,2 até a completa dissolução do ágar. -a- Meios em tubos: distribuir o meio ainda quente nos tubos obs.: Aferir o pH após a dissolução e depois autoclavar (no caso de necessitarmos utilizar agar dos componentes, distribuir nos inclinado, inclinar os tubos após autoclavação, com o meio tubos, acondicionar e esterilizar. ainda quente para solidificação ). -b- Meios em placas: autoclavar o balão onde foi preparado o meio e a seguir distribuí-lo ainda quente, em placas previamente esterilizadas em forno de ar quente. 19 TÉCNICAS DE SEMEADURA E ISOLAMENTO DE MICRORGANISMOS Isolamento de um microrganismo: O isolamento consiste na obtenção de uma cultura pura (colônias isoladas de um único microrganismo, separando-o de outros que se encontram no mesmo material ). Finalidades do isolamento: . Identificação de um microrganismo. A simples observação de caracteres morfológicos não é suficiente para a identificação e classificação dos microrganismos. Para isto lançamos mão da análise de uma série de características destes como: características bioquímicas, sorológicas, de patogenicidade, e etc. O estudo destas características está na dependência do microrganismo que se pretende identificar. . Semeadura: Consiste no plantio de um microrganismo em um meio de cultura, a partir de um material contaminado qualquer. . Repique: Consiste na transferência de um microrganismo de um meio de cultura para outro. . Técnica de semeadura ou repique de bactérias em meio líquido: 1- Segurar a alça com a mão direita, flambar primeiro na chama azul, depois na amarela. Esperar esfriar (a alça é flambada na posição vertical e deverá ficar atrás da chama para proteção do operador). 2- Retirar a rolha de algodão do tubo que contem o microrganismo a ser semeado ou repicado ( que deverá estar na mão esquerda ) utilizando-se o dedo mínimo da mão direita. A ROLHA DEVERÁ PERMANECER SENDO SEGURA COM O DEDO MÍNIMO, ATÉ O FINAL DA OPERAÇÃO. 3- Flambar a boca do tubo, e retirar o inóculo com a alça fria. 4- Flambar novamente a boca do tubo e fechar. 5- Pegar o tubo onde se irá realizar a semeadura, retirar a rolha e flambar. 6- Semear o material, flambar a boca do tubo e fechar. 7- Esterilizar a alça, identificar o tubo semeado e levar para incubação em estufa. Semeadura ou repique de bactérias em meio sólido inclinado: Os cuidados são os mesmos que para o meio líquido. Empregamos geralmente a alça. Quando necessitamos realizar semeadura de profundidade, utilizamos a agulha. O plantio é feito em zig-zag, iniciando-se pelo fundo do tubo. 20 Semeadura ou repique de bactérias em placas de Petri: O material a ser semeado deverá conter poucos microrganismos porque o inóculo para o isolamento deve ser leve. Lembrar que cada colônia formada na superfície de um meio sólido é originada de um ou alguns microrganismos. Quando maior o número, menor possibilidade de isolamento e maior probabilidade de crescimento confluente. Quando o inóculo for obtido a partir de meio sólido ( inóculo pesado ), este poderá ser diluído em salina estéril ou ser utilizada a técnica de esgotamento adequada. O inóculo obtido a partir de uma cultura em caldo ou de uma diluição da cultura em meio sólido é feito da seguinte maneira: 1. Retiramos o inóculo do tubo com a alça já flambada e fria. 2. Abrimos a placa, de modo que a tampa forme um chapéu com a placa . 3. Colocamos o inóculo junto a parte superior da placa, espalhando-o a seguir através de estriamento ( que poderá ser contínuo ou descontínuo ). O estriamento poderá se feito de maneiras variadas, tomando-se sempre o cuidado de nunca passar a alça duas vezes no mesmo local. O estriamento permite o esgotamento dos microrganismos que se encontram na alça. Quando passamos a mesma 2 vezes no mesmo local, promovemos o recarregamento do local, deixando ali mais bactérias, o que dificultará o seu perfeito isolamento. Durante o estriamento, após termos semeado metade da placa, deveremos cessar o mesmo. A seguir flambamos a alça, esperamos esfriar e continuamos o estriamento novamente, carregando a alça na última estria que realizamos. Após terminado o estriamento, fechar a placa e identificar, levando-a a seguir para incubação na estufa, com a tampa voltada para baixo. 4. Flambar a alça utilizada, esperar esfriar e guardar no suporte apropriado. OBS: Para a realização da semeadura utilizando-se inóculos pesados não diluídos, a técnica é a mesma que a descrita anteriormente, só que ao invés de interrompermos o processo uma vez para flambarmos a alça, o faremos duas vezes. Técnica de repique em meio semi-sólido: 1. Retirar o microrganismo do meio sólido ou líquido com o auxílio de uma agulha já flambada e fria. 2. Abrir o tubo que contém o meio semi-sólido e semear o microrganismo através de picada até mais ou menos 1/3 ou ½ do tubo. 3. Fechar o tubo, identificar e levar para incubação. 4. Flambar a agulha, deixar esfriar e colocar no suporte adequado. 21 EMPREGO DE MEIOS DE CULTURA SELETIVO-INDICADORES Os meios seletivo-indicadores são utilizados para selecionar grupos bacterianos ( através da utilização de substâncias inibidoras que impeçam o crescimento de bactérias indesejáveis ) e indicar uma propriedade bioquímica destas bactérias, que contribuam para o processo de identificação. AGAR MAC-CONKEY: Finalidade: meio de cultura seletivo-indicador, utilizado para isolamento de enterobactérias ( bacilos Gram negativos ) a partir de fezes, urina, líquor, alimentos, água residual, etc. FÓRMULA: Peptona de caseína cristal violeta Peptona de carne agar-agar Lactose água destilada Mistura de sais biliares Cloreto de sódio Vermelho neutro pH: + ou - 7.1 FUNDAMENTOS: 1) Os sais biliares e o cristal violeta inibem o crescimento da microbiota Gram-positiva por ventura existente no material (seletividade para Gram-negativo). 2) A lactose junto com o indicador de pH (vermelho neutro) serve para comprovar a degradação ( fermentação ) deste carboidrato ( o que é feito por apenas parte dos membros desta família). Quando ocorre a fermentação, a bactéria é classificada como Lac +. LEITURA: • Colônias lactose-positiva (Lac. +) : degradação ( fermentação ) da lactose com acidificação do meio que produzirá colônias de cor rosa com halo central mais claro. Ex.: E. coli, Klebsiella, Enterobacter. • Colônias lactose-negativa (Lac. -): não utilização da lactose, formação de colônias incolores e transparentes. As colônias assumem a coloração do meio, que se apresentará um pouco alterado, devido a utilização dos outros componentes ( só não utilizará a lactose) . Ex.: Proteus, Salmonella, Shigella. 22 PROVAS BIOQUÍMICAS UTILIZADAS NA IDENTIFICAÇÃO DE BACTÉRIAS METABOLISMO DE CARBOIDRATOS 1- Fermentação de carboidratos: Algumas bactérias são capazes de hidrolizar os carboidratos (dissacarídeos até glicose), e metabolizar a glicose até ácidos (com ou sem liberação de gás) e/ou álcoois. Carboidrato ( manitol, sacarose, lactose, etc. ) glicose ác. pirúvico ácidos, álcoois e gases. Meio utilizado: meio de cultura indicador que contém: caldo simples + carboidrato + indicador de pH (indicador de Andrade ) + tubo de Durhan. TÉCNICA: a) repicar o microrganismo já isolado para o meio contendo o carboidrato e incubar em estufa a 37° C por 24 horas. b) Leitura: observar se houve produção de ácidos (viragem da cor do meio) com ou sem produção de gás (formação de bolha no interior do tubo de Durhan). 2- Prova do citrato: Muitas bactérias são capazes de utilizar o citrato (ác. orgânico do ciclo de Krebs) como fonte de carbono .A enzima que cataliza a clivagem do citrato recebe várias denominações, dentre elas, citratoliase e citrilase. Os produtos de clivagem são acetato e oxaloacetato, este último sendo subseqüentemente convertido em Piruvato e CO2 , por uma oxalacetato descarboxilase. citrato citrilase oxalacetato + acetato oxalacetato descarboxilase Ác. Pirúvico + CO2 O piruvato é utilizado pela célula ( para seu metabolismo ) e o CO2 é liberado no meio de cultura. O CO2 liberado reage então com o sódio ( proveniente do sal citrato de sódio incorporado na composição do meio de cultura ), formando carbonato de sódio ( composto alcalino ), que promove a viragem da cor do meio, devido a alcalinização. Meio utilizado: Citrato de Sódio + H2O + Indicador de pH ( azul de bromotimol ). O pH final do meio após preparo: 6.8 . Indicador de pH: azul de bromotimol: verde em meio ligeiramente ácido ( 6.8 ) e azul em pH acima de 7,6. Técnica: repicar o microrganismo já isolado no meio do citrato e incubar na estufa a 37° C por 24 horas. Leitura: - teste positivo: meio de cultura azul (a bactéria utilizou o citrato, liberando CO2,) - teste negativo: meio inalterado ( verde ): bactéria não utilizou o citrato. 23 METABOLISMO DE PROTEÍNAS A decomposição de proteínas ( liberação de aminoácidos ) conduz à produção de substâncias pútridas (de mal cheiro) como: H2S, Indol e escatol e etc. Neste experimento, observaremos a utilização ou não de certos aminoácidos pelas bactérias ( necessários ao seu metabolismo ), através da detecção da presença de substâncias pútridas. Meio de cultura utilizado: Meio SIM. ( S=sulfeto; I=indol; M=motilidade ) Composição: peptona (proteína que serve como fonte de tryptofano e cistina), sal de metal pesado (sal de ferro ou chumbo), água e ágar. TÉCNICA: Semear com agulha ( picada até + ou - 1/3 do tubo ) a bactéria já isolada para o meio SIM. Incubar em estufa a 37ºC por 24 horas. Após incubação, adicionar de 3 a 5 gotas do reativo de Kovacs e proceder a leitura. FUNDAMENTO: 1- Produção de Indol: degradação do tryptofano Tryptofano triptofanase produzida pela bactéria Ác. pirúvico e indol Ác. pirúvico: utilizado pelo metabolismo da bactéria. Indol: liberado no meio de cultura. Adicionar após incubação, de 3 a 5 gotas do reativo de Kovacs ( solução de paradimetilaminobenzaldeido ). Se houver liberação de indol, formar-se-á um anel vermelho ( composto denominado rosindol) Resultado: - Indol positivo: anel vermelho - Indol negativo: não utilização do tryptofano. Presença de anel amarelo (cor do reativo de Kovacs) 2- Produção de H2S: Cistina: aminoácido que contém enxofre (S). Degradação da cistina com liberação de H2S. Cistina 2 cisteína cisteína dessulfidrilase H2S + ác. pirúvico produzida pela bactéria Ác. pirúvico; utilizado no metabolismo da bactéria. H2S: liberado no meio de cultura. O H2S liberado combina-se com o sal de ferro ou chumbo, dando como resultado um precipitado de cor negra. Resultado: - H2S positivo: precipitado preto - H2S negativo: sem precipitado 24 TESTE DE SUSCEPTIBILIDADE AOS ANTIMICROBIANOS ( TSA ) / ( ANTIBIOGRAMA ) 1. CONCEITO e INTRODUÇÃO: Teste para verificar o comportamento dos microrganismos (sensibilidade ou resistência) "in vitro", frente a diversos antibióticos e quimioterápicos, para a escolha do antimicrobiano ideal. A orientação fornecida pelo TSA sobre a eficácia de determinada droga contra um agente infeccioso pode vir a ser de grande importância, visto que diferentes espécies bacterianas, ou diferentes cepas de uma mesma espécie, podem demonstrar diferentes níveis de sensibilidade a uma droga. Neste particular, destaca-se a resistência infecciosa protagonizada por diversos gêneros bacterianos. Multiresistência de origem plasmidial talvez seja a principal causa do surgimento de cepas resistentes, aliada à seleção natural que ocorre entre populações bacterianas. Suassuna: “Para o sucesso da antibioticoterapia, a partir do conhecimento de um agente etiológico cuja sensibilidade foi indicada pelo laboratório, há de se considerar, entre tantos condicionantes para o êxito do tratamento, se as lesões são abertas ou fechadas; contaminadas ou não; purulentas ou granulomatosas; superficiais, justamucosas, profundas ou sob barreiras anatômicas”. Critério absoluto da eficácia de um antibiótico Resposta clínica do paciente quando a ele se administra a dose adequada da droga correta. 2. INDICAÇÕES: Para microrganimos isolados e identificados como os agentes causadores da infecção; quando o microrganismo causador da infecção apresenta, estatisticamente, grande variabilidade no espectro de resistência ou tendência à mesma. Ex.: Enterobactérias, Staphylococcus aureus, Pseudomonas. 3. DISPENSADO: Para microrganismos, cuja sensibilidade não apresenta variação ao longo do tempo. Ex.: Neisseria meningitidis e Streptococcus do grupo A (sensíveis à penicilina G), Salmonella typhi (sensível ao cloranfenicol) 4. TIPOS DE TESTE: 4.1. QUANTITATIVO: determinação da Concentração inibitória mínima (CIM). - Diluição : em tubo e em placa - Teste E (Teste epsilométrico): consiste em uma fita plástica, impregnada com um gradiente de concentração do antimicrobiano. 25 4.2. QUALITATIVO: Método de difusão de discos em ágar. PRINCÍPIO DO MÉTODO QUALITATIVO: medida do halo de inibição em mm. LEITURA: - ausência de halo: resistência - presença de halo: sensibilidade ou resistência 5. FATORES QUE INFLUENCIAM O RESULTADO DO TSA: 5.1. COMPOSIÇÃO QUÍMICA DO MEIO DE CULTURA: Meio de cultura padrão para a realização do TSA: Agar Müeller-Hinton (pH: 7.2 a 7.4), em placas com 4 a 6 mm de espessura. Permite bom crescimento do microrganismo e boa difusibilidade do antibiótico, podendo ainda se necessário, ser acrescido de sangue. 5.2. DENSIDADE DO INÓCULO: concentração do inóculo: 108 células/mL. 5.3. TEMPERATURA: A temperatura de incubação ideal se situa entre: 35 a 37ºC. Temperaturas alteradas podem conduzir a uma deterioração do fármaco ou no caso dos microrganismos produtores de enzimas, a produção de enzimas poderá ser baixa e quantidade tão pequena que haverá a formação de halo maior ( falso-positivo ). 26 5.4. CONCENTRAÇÃO DOS ANTIMICROBIANOS NOS DISCOS: padronizada pelo fabricante. 5.5. VALIDADE E CONSERVAÇÃO DOS DISCOS: observar sempre: a data de validade, a umidade e a temperatura ideal de armazenamento 5.6. AÇÃO E ESTABILIDADE DA DROGA: . algumas drogas podem sofrer hidrólise nas primeiras horas de incubação (o que possibilita o desenvolvimento dos microrganismos, mesmo que sensíveis a elas ) . alguns microrganismos se reproduzem antes de serem inibidos pela droga (velocidade de crescimento maior que a velocidade de difusão da droga. Tais fatos permitem o surgimento de “colônias satélite” (colônias que podem surgir dentro do halo de inibição). Além destas, outras explicações são atribuídas ao surgimento de colônias satélite: inoculo misto e mutantes resistentes ao antimicrobiano dentro da população. 5.7. TEMPO DE INCUBAÇÃO: de 12 a 18 horas 5.8. INTERPRETAÇÃO: medida do diâmetro do halo de inibição (mm). 6. RESULTADO: - Sensível (S), - Moderadamente resistente ou intermediário (I), - Resistente (R). TESTE DE SUSCEPTIBILIDADE AOS ANTIMICROBIANOS ( TSA ) / (ANTIBIOGRAMA) MÉTODO DE KIRBY-BAUER Método de difusão em meio de cultura sólido pelo sistema de discos únicos. Padronizado pela OMS em 1977. Características necessárias ao meio de cultivo para TSA: • O meio de cultivo, sem enriquecimento, deve sustentar o bom crescimento dos organismos em teste. • Não deve possuir substâncias que antagonizem os antibióticos testados. • Deve ser resistente a mudanças de pH durante o período de incubação. • Deve permitir o acréscimo de sangue quando o organismo em teste exigir. 27 • Meio não deve conter carboidratos fermentáveis porque o pH ácido estimula as ciclinas (enquanto que o pH alcalino estimula aminoglicosídeos e macrolídeos). • O pH do meio deve manter-se entre 7,2 e 7,4. O meio Miller – Hinton satisfaz parcialmente estas exigências, sendo recomendado por diversos autores. Quando usado para o teste de difusão, deve ser adicionado às placas em quantidade suficiente para que solidifique com uma espessura de 4 mm. MATERIAL: . suspensão bacteriana em caldo ( concentração: 108 células/mL). - É recomendado um inóculo correspondente ao padrão 0,5 da escala de MacFarland. . placa contendo meio de cultura padrão: Agar Müeller-Hinton . cotonete estéril ( para a semeadura) . discos de papel contendo os antimicrobianos ( em concentrações padronizadas ) Escala de MacFarland: Preparar solução de ácido sulfúrico a 1%. Preparar solução aquosa de cloreto de bário a 1,175%. Lentamente, e sob constante agitação, adicionar as quantidades indicadas a 10 tubos previamente preparados. Fechar os tubos hermeticamente, conservando-os à temperatura ambiente e ao abrigo da luz. O precipitado de sulfato de bário, quando ressuspendido, corresponde à densidade conferida por cultivo de E. coli em meio líquido, nas concentrações relacionadas na tabela: 0,5 1 2 3 4 5 6 7 8 9 10 BaCl2(ml) 0,05 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 H2SO4(ml) 9,95 9,9 9,8 9,7 9,6 9,5 9,4 9,3 9,2 9,1 9,0 3 6 9 12 15 18 21 24 27 30 Concentração 1,5 (x108/ml) O inóculo pode ser obtido de formas variadas: • Selecionar 4 – 5 colônias desenvolvidos em meio sólido e que apresentem o mesmo tipo morfológico. Transferir estas colônias para o meio líquido. 28 Incubar a 35 – 370C até turvação visível (normalmente entre 2 a 8 horas). Ajustar a turvação com salina estéril ou meio líquido até a concentração desejada. • Obter suspensão bacteriana em salina estéril ou em meio líquido a partir de colônias que se tenham desenvolvido em meio sólido. Utilizar tantas colônias quantas forem necessárias para a obtenção da turvação visível. Ajustar a turvação com salina estéril ou meio líquido até obter a concentração desejada. Obs: Esse método é recomendado especialmente para bactérias que se desenvolvem com dificuldade em meio líquido. TÉCNICA: . retirar a suspensão bacteriana contida no tubo com o cotonete , tomando o cuidado de retirar o excesso de caldo , comprimindo a haste contra a parede do tubo; . semear a suspensão na placa contendo o Agar Müeller-Hinton, em três planos, para que haja crescimento confluente; . deixar a placa secar entreaberta durante no máximo, por 15 minutos, em frente à chama; . colocar os discos de papel com o auxílio de uma pinça flambada, resguardando um espaço de 2 cm do disco para a borda da placa e de 3 cm entre um disco e outro; . esperar de 20 a 30 minutos para que ocorra a difusão do antimicrobiano, antes que o microrganismo comece a se desenvolver; . levar à estufa a 35 ou 37º durante 12 a 18 horas; . após a incubação, promover a leitura e interpretação. OBSERVAÇÕES: OBS: Staphylococcus sp., o período de incubação deve ser prolongado até 24 horas, visando detecção de cepas meticilina resistentes (O.R.S.A.). Incubação em atmosfera de microaerofilia não é recomendada, uma vez que o CO2 proporciona acidificação da superfície do meio de cultivo. Organismos que requerem CO2 para seu desenvolvimento devem ser testados (N. gonorrhoeae, N. meningitidis, H. influenzae) no ambiente solicitado, ainda que, idealmente, o procedimento deva ser acompanhado por teste paralelo com cepa padrão. 29 Leituras: Resultados quantitativos expressos em concentração inibitória mínima. Resultados qualitativos como sensível, intermediário, resistente. Interpretação de antibiogramas recomendada pelo NCCLS: Sensível (S): Uma infecção por determinada cepa pode ser tratada apropriadamente com dosagem de agente antimicrobiano recomendada para aquela infecção, salvo qualquer outra contra – indicação. Intermediária (I): A CIM dos agentes antimicrobianos aproximam-se dos níveis plasmáticos e tissulares habituais. Pode apresentar uma resposta menor que a das cepas sensíveis. Resistentes (R): Cepas não são usualmente inibidas por concentrações sistêmicas avaliadas do agente. Staphylococcus sp meticilina – resistente (heterorresistente) O mecanismo de resistência está relacionado à alteração de PBP codificada pelo gene mec A. Cepas com o gene mec A habitualmente são multirresistentes, e o resultado da resistência à oxacilina deve ser confirmado. Pesquisa tradicional discos de oxacilina 1 µg. Disco de cefoxitina 30 µg detecta de forma segura todas as classes de MRSA, mesmo cepas que apresentam resistência à oxacilina em baixos níveis. Reportar como resistente a oxacilina, penicilina, Beta – lactâmicos, Beta – lactâmicos mais inibidores, cefens, monabactans, carbapenens. Seleção de antimicrobianos: • Antimicrobianos devem ser os mais adequados para o microrganismo isolado e o sítio da infecção. • Devem ser adequados ao hospital ou à instituição. • Orientações publicadas anualmente pelo NCCLS (National Committee for Clinical Laboratory Standards). Controle de qualidade: • Utilização de cepas padrão para verificação dos testes. • Cepas padrão ATCC (American Type Culture Collection). Exemplos: E. coli ATCC 25922 β - Lactamase negativa para controle de discos para enterobactérias. 30 Klebsiella pneumoniae ATCC 700603 Controle de discos para detecção de cepas K. pneumoniae, E. coli, K. oxytoca ESBL (extended spectrum beta lactamase). S. aureus ATCC 25923 Cepa β - Lactamase negativa para controle de discos de Gram positivos. Freqüência do teste de controle de qualidade: Cada novo lote do meio preparado, cada novo lote de antibiótico recebido no laboratório. Atentar para microrganismos com resistência intrínseca (microrganismos que, se reportados como resistentes, a identificação deve ser revista). Guia para realização do teste de avaliação da resistência pelo método de difusão em disco: 31 PRINCIPAIS CLASSES DE ANTIBIÓTICOS 32 ISOLAMENTO E IDENTIFICAÇÃO DE FUNGOS 1 - INTRODUÇÃO: 1.1 - IMPORTÂNCIA DO ESTUDO DOS FUNGOS Os fungos são seres vivos e apresentam uma característica marcante que é a ubiqüidade, ou seja, se encontram amplamente disseminados na natureza, onde desempenham efeitos benéficos (manutenção do equilíbrio dos diversos ecossistemas, participação no ciclo de vida na terra, fertilização do solo, etc.) e maléficos (causando doenças e deteriorando alimentos e materiais) para a humanidade. Ressalta-se também a utilização desses microrganismos em indústrias de alimento e bebidas (queijo, pão, vinho, cerveja, etc.), farmacêutica (antibióticos, hormônios, alucinógenos) e química (enzimas, ácidos orgânicos, vitaminas, pigmentos, etc.). Os fungos são também largamente usados como ferramentas em pesquisa básica de genética, fisiologia, bioquímica, entre outras. O habitat natural desses microrganismos é bastante variado, permitindo classificá-los como anemófilos (fungos do ar), geofílicos ou telúricos (do solo), aquáticos (da água), zoofílicos (de animais), antropofílicos (do homem) e fitofílicos (de vegetais). Portanto, é possível promover o isolamento desses microrganismos de qualquer um destes locais, ou de materiais como madeira, couro, alimentos e detritos de um modo geral. Para isto, é necessário que sejam fornecidas condições ambientais e nutrientes adequados para promover o desenvolvimento destes microrganismos nos meios de cultura. 1.2 - FINALIDADES DO ISOLAMENTO São várias as situações onde se faz necessário o isolamento dos fungos: - Estudo da microbiota fúngica de determinada região. - Avaliação de poluição ambiental. - Determinação do grau de contaminação de determinados ambientes. - Verificação de contaminação de alimentos e medicamentos. - Obtenção de amostras de interesse industrial. - Diagnóstico etiológico de micoses. - Obtenção de amostras para o preparo de antígenos. - Estudo da correlação de alergia com a presença de fungo no ambiente. 1.3 - OBJETIVO DAS AULAS Apresentar as técnicas mais utilizadas em micologia, discutindo a metodologia de isolamento e identificação de fungos. Para tal, usaremos um modelo de estudo dos fungos anemófilos, que pode ser adaptado para outras investigações. 33 2 - ISOLAMENTO DOS FUNGOS 2.1 - SEMEADURA EM MEIOS DE CULTURA a) Meio de cultura mais utilizado: Agar Sabouraud Composição química: água, agar-agar, peptona, dextrose ou maltose, pH: ácido (em torno de 5.6) b) Outros meios de cultura utilizados em micologia: - Agar Mycosel - este meio apresenta composição química semelhante ao Agar Sabouraud, porém acrescido de antimicrobianos (Cloranfenicol - antibacteriano e Cicloheximida ou Actidione - inibidor do crescimento de fungos saprófitas), sendo muito utilizado no isolamento de fungos patogênicos. O Agar Mycosel é um meio seletivo para isolamento de fungos patogênicos. - DTM - meio seletivo e indicador utilizado no isolamento de dermatófitos. - Czapeck-Dox - utilizado no isolamento de fungos presentes em escarro e outras secreções ( tem substâncias que fluidificam o muco). - Chlamydospore agar - utilizado para induzir a formação de clamidosporos. - Agar fubá, agar arroz, agar batata - meios pobres, mas ricos em carboidratos que estimulam a esporulação, sendo usados no microcultivo 8.2 - CONDIÇÕES DE INCUBAÇÃO: - Temperatura: - ambiente - para os fungos dimórficos: 1 tubo a 37ºC e outro à temperatura ambiente. - Atmosfera: aerobiose - Tempo: fungos saprófitas - em torno de 3 dias ( 3 a 7 dias) fungos patogênicos - de 5 a 30 dias 2.3 - ACOMPANHAMENTO DO DESENVOLVIMENTO E ANÁLISE DA COLÔNIA 3 - IDENTIFICAÇÃO DE FUNGOS A identificação dos fungos se baseia principalmente em características morfológicas (macro e microscópicas), reprodutivas e metabólicas. 3.1 - CARACTERÍSTICAS MACROSCÓPICAS Na análise da morfologia colonial várias características devem ser observadas como: aspecto da colônia, cor, bordos, superfície, consistência, presença de protuberância e sulcos. 34 3.2 - CARACTERÍSTICAS MICROSCÓPICAS Nesta observação devemos analisar não apenas a micromorfologia como também aspectos relacionados à reprodução dos fungos. Verifica-se, portanto, se o microrganismo é uni ou multicelular, a forma e tamanho das células, a presença de hifas, de células leveduriformes e de pseudo-hifa, se a hifa é septada ou cenocítica, a presença de estruturas facultativas (cápsula, rizóides e haustórios), o tipo de reprodução e o aspecto dos esporos e do corpo de frutificação. 3.3 - CARACTERÍSTICAS METABÓLICAS (OU BIOQUÍMICAS) São várias as provas de identificação de fungos que se baseiam em aspectos metabólicos. Dentre elas podemos citar o zimograma (prova de fermentação de carboidratos), o auxanograma (prova de assimilação de carboidratos e de compostos nitrogenados) e pesquisa de enzimas (urease, por exemplo). Estas provas bioquímicas (principalmente zimograma e auxanograma) são indispensáveis na identificação de leveduras. 3.4 - OUTRAS PROVAS DE IDENTIFICAÇÃO . Tubo germinativo . Termotolerância . Dimorfismo . Perfuração do pêlo . Sensibilidade à cicloheximida 4 - TIPOS DE EXAMES MICROSCÓPICOS: 4.1 - COLORAÇÃO DE GRAM Esta coloração, muito utilizada na bacteriologia, permite também a observação microscópica dos fungos, desde que a colônia ou o material a ser analisado permita a confecção e fixação de esfregaço, conforme recomendado para tal método. Os fungos são Gram positivos, ou seja, se coram de roxo. 4.2 - TRATAMENTO PELA POTASSA ( KOH ) Este é o procedimento mais utilizado para exame direto de espécimes clínicos (escamas de pele, pêlos, fragmentos de unha, escarro, secreções, etc.). O hidróxido de potássio (usado em concentrações de 20 a 40%) é uma substância clareadora que digere os elementos tissulares, permitindo uma melhor visualização das estruturas fúngicas (hifas, células leveduriformes, esporos). 35 4.3 - COLORAÇÃO COM TINTA NANQUIM A tinta nanquim ou tinta da China é um corante utilizado para verificação da presença de cápsula (que não se cora). Ex: Cryptococcus neoformans, Rhodotorula. 4.4 - COLORAÇÃO COM LACTOFENOL DE AMANN OU AZUL DE ALGODÃO O lactofenol é o corante mais utilizado para observação microscópica de fungos, após o seu desenvolvimento em meios de cultura. Na sua composição química encontramos: água, fenol, ácido lático, glicerina e azul de algodão (ou de metila). O estudo da micromorfologia dos fungos, corado pelo lactofenol, pode ser realizado basicamente através de 2 técnicas: retirada de fragmentos de colônia e o microcultivo. A técnica do microcultivo (ou cultura em lâmina) pode ser realizada em uma placa de Petri contendo uma lâmina sobre um suporte de vidro. Esta vidraria é previamente esterilizada e sobre a lâmina coloca-se um bloco (um cubo) do meio de cultura. Geralmente se usa o agar batata para o estudo dos bolores e agar fubá para leveduras. O fungo a ser analisado é então repicado para o pedaço de meio de cultura e coberto com lamínula. Para se criar um ambiente úmido, coloca-se um pouco de água destilada estéril dentro da placa, que é incubada à temperatura ambiente. Após 15 dias, ou quando houver um bom desenvolvimento do fungo no meio de cultura (inclusive na lamínula), retira-se a lamínula que deverá ser colocada sobre uma outra lâmina com 1 gota de lactofenol e observada ao microscópio, no menor, médio e maior aumento. 4.5 - EXAME COM FITA DUREX Esta técnica permite a colheita de material e observação microscópica de casos de pitiríase versicolor (micose de pele causada pela levedura Malassezia furfur). 4.6 - EXAME HISTOPATOLÓGICO Os exames histopatológicos são de grande relevância no diagnóstico de doenças infecciosas e permitem a detecção de fungos nos tecidos. 5- ATIVIDADES A SEREM DESENVOLVIDAS NAS AULAS PRÁTICAS SOBRE ISOLAMENTO E IDENTIFICAÇÃO DE FUNGOS ANEMÓFILOS . Observação de exposição sobre fungos . Descrição da morfologia colonial: Os alunos deverão observar todas as colônias expostas, procurando analisar as semelhanças e diferenças entre os mesmos tipos morfológicos. A seguir, escolher uma colônia de bolor e uma de levedura (da nossa micoteca) e anotar as principais características de cada uma, fazendo a diferenciação entre elas. 36 A tabela de identificação macromorfológica dos fungos (em anexo) poderá servir de base para tal descrição. . Observação da micromorfologia Os alunos deverão fazer observação microscópica dos fungos focalizados, analisando as características e diferenças de micélio, órgãos de reprodução (corpo de frutificação) e esporos. Anotar (ou desenhar) as características observadas. Correlacionar os dados da micromorfologia dos fungos focalizados com os tipos expostos em culturas. Muitos fungos expostos nas culturas estão igualmente focalizados nos microscópios. Coleta de material Os alunos deverão escolher um ambiente para investigar a presença de fungos anemófilos. Neste local, as placas de Petri contendo agar Sabouraud deverão ser abertas e expostas ao ar, aproximadamente 15 minutos. Em seguida, as placas serão fechadas, por identificadas e incubadas à temperatura ambiente. . Acompanhamento do desenvolvimento de colônias Os alunos deverão retornar ao laboratório todos os dias para acompanhar o experimento e verificar se está havendo crescimento de colônias de fungos na superfície dos meios de cultura. Anotar o tempo de crescimento, o número e variedade de colônias. Comparar com a de outros colegas e tentar determinar possíveis diferenças ou semelhanças. . Descrição da morfologia colonial: ( dos isolados em sua placa): Após o desenvolvimento dos fungos no meio de cultura, escolher uma colônia e descrever a sua macromorfologia. . Descrição da micromorfologia: A colônia de fungo anemófilo escolhida será agora analisada sob o aspecto microscópico, utilizando a técnica de fragmento de colônia. Com a agulha de platina flambada e fria, raspar a superfície da colônia escolhida para obter pequenos fragmentos. Estes serão colocados sobre uma lâmina, juntamente com 1 gota de lactofenol e cobertos por lamínula. Em seguida, observar ao microscópio no menor, médio e maior aumento. Anotar (ou desenhar) as características observadas. Estes dados poderão permitir a identificação do fungo escolhido. . DESCRIÇÃO FINAL DO FUNGO ESCOLHIDO: Baseando-se na análise da macro e micromorfologia do fungo por sua equipe escolhido, dê sua descrição final, e se possível, o gênero a que este fungo pertence. 37 TABELA DE IDENTIFICAÇÃO MACROMORFOLÓGICA DOS FUNGOS 1- Micélio ( aspecto macroscópico ): ( ) leveduriforme (levedura) ( ) filamentoso (bolor) ( ) aéreo ( o que se projeta acima do meio de cultura) ( ) rasteiro (o que cresce sobre ou abaixo do meio de cultura) 2- Cor da colônia: ......................................................................... 3- Presença de pigmento: ( reverso da colônia - verso da placa) .............................................................. 4- Bordos: ( ) inteiro ( ) franjado ( ) ondulado ( ) liso ( ) encrespado 5- Superfície: ( ) lisa ( ) rugosa ( ) mucóide ( ) cremosa ( ) arredondado ( ) cerebriforme ( ) concêntrica ( ) coriácea ( ) opaca ( ) algodonosa ( ) aveludada ( ) brilhante ( ) pulverulenta ( ) pastosa 6- Sulcos: ( ) presentes 7- Tipo: ( ) seca ( ) ausentes ( ) úmida 8- Protuberância central: ( ) presente 9- Elevação: ( ) achatada ( ) ausente ( ) levantada ( ) amontoada 10- Reverso da colônia: ............................................................................................................................. 11- Morfologia colonial final após a identificação: ......................................................................................... ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ OBS: Esta tabela tem por finalidade orientá-lo na verificação das principais características macromorfológicas que deverão ser observadas. Entretanto, não significa que a colônia que você deseja identificar tenha todos os itens descritos acima, e além disto, para cada item poderá ser observada mais de uma característica. (por exemplo: a superfície de uma colônia poderá ser ao mesmo tempo: lisa, pastosa e brilhante).
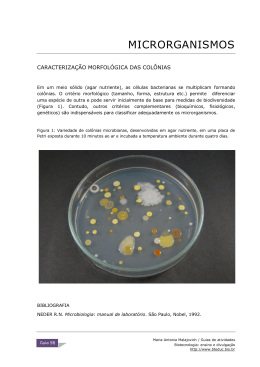
Download