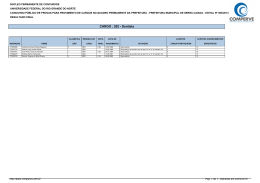
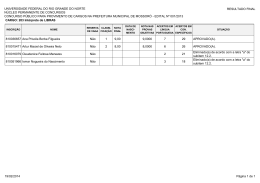
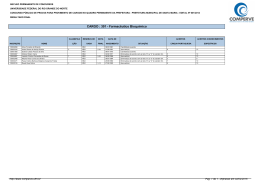
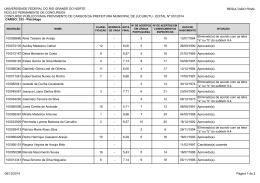
SEGUNDO EXAME QUALIFICAÇÃO UERJ 2011 MATERIAL RETIRADO DO SITE: http://www.revista.vestibular.uerj.br/ 01. O grupo funcional encontrado nos três compostos que participam das etapas representadas é: (A) fosfato (B) hidroxila (C) carbonila (D) carboxilato Alternativa correta: (D) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Funções químicas Subitem do programa: Classificação e nomenclatura das substâncias orgânicas Objetivo: Nomear grupamento funcional comum a três íons orgânicos. Comentário da questão: O grupamento funcional presente nos três íons é o carboxilato, que caracteriza os sais orgânicos. Sua fórmula estrutural é: Percentual de acertos: 42,54% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ______________________________________________________________________ 02. Considere agora o processo fermentativo do fungo Saccharomyces cerevisiae, ou levedo de cerveja. Neste processo, no lugar do lactato, a substância final formada será: (A) etanol (B) glicose (C) glicerol (D) sacarose Alternativa correta: (A) Eixo interdisciplinar: Os Seres Vivos e sua Relação com o Ambiente Item do programa: A célula Subitem do programa: Noções de metabolismo Objetivo: Nomear a substância formada na etapa final da fermentação da glicose pelo levedo de cerveja. Comentário da questão: No levedo de cerveja, o piruvato originário da glicólise é diretamente descarboxilado e reduzido, produzindo álcool etílico ou etanol. Percentual de acertos: 55,20% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ________________________________________________ 03. A única caixa que contém apenas metais está indicada pela seguinte letra: (A) W (B) X (C) Y (D) Z Alternativa correta: (D) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: Os tipos de átomos Subitem do programa: Classificação Objetivo: Reconhecer elementos químicos classificados como metais. Comentário da questão: Na tabela periódica, são identificados quatro tipos de elementos químicos - hidrogênio, metais, ametais e gases nobres. Observe: A caixa Z, portanto, é a única que contém apenas metais - alumínio, ferro e cádmio. Percentual de acertos: 69,80% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ________________________________________ 04. O nitrogênio é um dos principais gases que compõem o ar atmosférico. No esquema abaixo, estão resumidas algumas etapas do ciclo biogeoquímico desse gás na natureza. O processo de nitrificação, composto de duas etapas, e o de desnitrificação, ambos executados por microrganismos, estão identificados, respectivamente, pelos seguintes números: (A) 2 e 3; 4 (B) 1 e 5; 7 (C) 4 e 6; 8 (D) 2 e 5; 1 Alternativa correta: (A) Eixo interdisciplinar: Os Seres Vivos e sua Relação com o Ambiente Item do programa: Integração meio ambiente/ser vivo Subitem do programa: Ciclos biogeoquímicos Objetivo: Identificar etapas do ciclo biogeoquímico do nitrogênio. Comentário da questão: A nitrificação é composta das etapas de transformação de amônio (NH4+) em nitrito (NO2-) e de oxidação do nitrito (NO)2- a nitrato ((NO3-). Já a desnitrificação consiste na redução do nitrato ((NO3-) a nitrogênio gasoso (N2). Essas etapas estão indicadas no esquema, respectivamente, pelas setas 2 e 3 e pela seta 4. Percentual de acertos: 40,70% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) __________________________________________________________________________ 05. O ácido não oxigenado formado por um ametal de configuração eletrônica da última camada 3s23p4 é um poluente de elevada toxicidade gerado em determinadas atividades industriais. Para evitar seu descarte direto no meio ambiente, faz-se a reação de neutralização total entre esse ácido e o hidróxido do metal do 4º período e grupo IIA da tabela de classificação periódica dos elementos. A fórmula do sal formado nessa reação é: (A) CaS (B) CaCl2 (C) MgS (D) MgCl2 Alternativa correta: (A) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: O átomo como unidade da matéria Subitem do programa: Configuração eletrônica Eixo interdisciplinar 2: As Substâncias e suas Transformações Item do programa 2: Funções químicas Subitem do programa 2: Classificaçao das substâncias inorgânicas Eixo interdisciplinar 3: As Substâncias e suas Transformações Item do programa 3: Reações químicas Subitem do programa 3: Dupla troca Objetivo: Transferir conhecimentos acerca de funções químicas para identificação do sal formado em uma reação de neutralização. Comentário da questão: O ametal apresenta a seguinte distribuição eletrônica: 1s2 2s2 2p6 3s2 3p4 Seu número atômico é 16; logo, esse elemento é o enxofre. O ácido não oxigenado formado pelo enxofre é o ácido sulfúrico (H2S). O metal do 4º período e grupo IIA da tabela de classificação periódica dos elementos é o cálcio, e o hidróxido do cálcio é o Ca(OH) 2. Esses dois compostos reagem de acordo com a seguinte equação química: H2S + Ca(OH)2 CaS + H2O Logo, o sal formado nessa reação é o sulfeto de cálcio (CaS). Percentual de acertos: 58,65% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ___________________________________________________________________________ 06. A ferrugem contém uma substância que é formada pela reação do oxigênio do ar com o ferro presente em uma superfície metálica. Esse processo pode ser representado pela seguinte equação química: Nesse processo, o oxigênio sofre a transformação química denominada: (A) redução (B) oxidação (C) esterificação (D) neutralização Alternativa correta: (A) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Reações químicas Subitem do programa: Oxirredução Objetivo: Discriminar a transformação química do oxigênio em uma reação. Comentário da questão: Na reação química de oxirredução, elétrons são transferidos do ferro para o oxigênio. Observe: Logo, a transformação química do oxigênio é de redução. Percentual de acertos: 36,72% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) _____________________________________________________________________________ 07. A ferrugem contém uma substância que é formada pela reação do oxigênio do ar com o ferro presente em uma superfície metálica. Esse processo pode ser representado pela seguinte equação química: Nesse processo, o oxigênio sofre a transformação química denominada: (A) redução (B) oxidação (C) esterificação (D) neutralização Alternativa correta: (A) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Reações químicas Subitem do programa: Oxirredução Objetivo: Discriminar a transformação química do oxigênio em uma reação. Comentário da questão: Na reação química de oxirredução, elétrons são transferidos do ferro para o oxigênio. Observe: Logo, a transformação química do oxigênio é de redução. Percentual de acertos: 36,72% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) _____________________________________________________________________________ 08. Considere uma mistura homogênea que contém quantidades iguais de quatro substâncias orgânicas: hexano, pentano, ácido etanoico e metilbenzeno. Com a adição de uma determinada quantidade de água, obteve-se uma mistura heterogênea, como ilustra o esquema a seguir: Na fase aquosa da mistura heterogênea, apenas a substância orgânica de maior solubilidade em água está presente. Essa substância é denominada: (A) hexano (B) pentano (C) ácido etanoico (D) metilbenzeno Alternativa correta: (C) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: Íons e moléculas Subitem do programa: Ligações químicas, geometria molecular e interações intermoleculares Objetivo: Discriminar a polaridade das substâncias químicas presentes em uma mistura. Comentário da questão: A análise das fórmulas estruturais das substâncias que compõem a mistura permite identificar a polaridade de cada uma. Observe: O ácido etanoico é uma molécula polar, em função da diferença de eletronegatividade entre os atómos de oxigênio e carbono e de hidrogênio. Já as demais moléculas são apolares, pois apresentam átomos de carbono e de hidrogênio, que formam apenas ligações apolares entre si. Como a água é uma molécula polar, irá se solubilizar em água o composto polar presente na mistura, no caso, o ácido etanoico. Percentual de acertos: 56,94% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) _____________________________________________________________________________ 09. A fim de aumentar a velocidade de formação do butanoato de etila, um dos componentes do aroma de abacaxi, emprega-se como catalisador o ácido sulfúrico. Observe a equação química desse processo: As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico: (A) (B) (C) (D) Alternativa correta: (B) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Cinética reacional Subitem do programa: Velocidade de reação e fatores de interferência Item do programa 2: Equilíbrio químico Subitem do programa 2: O estado de equilíbrio e suas perturbações Objetivo: Explicar a função de um catalisador em uma reação química. Comentário da questão: A adição de um catalisador acarreta o aumento da velocidade de uma reação química. Entretanto, o catalisador não altera o estado de equilíbrio, pois ele atua tanto sobre a reação direta quanto sobre a reação inversa. Portanto, na reação na qual se emprega o catalisador, o estado de equilíbrio é alcançado em um tempo menor, pois a velocidade de formação do butanoato de etila será maior. Todavia, ao atingir o estado de equilíbrio, a concentração de butanoato de etila é a mesma para ambos os experimentos. Assim, as curvas de produção de um componente químico, com e sem a presença de um catalisador, poderiam ser representadas pelo gráfico abaixo: Percentual de acertos: 36,12% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) _____________________________________________________________________________ 10.
Download