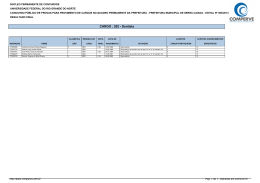
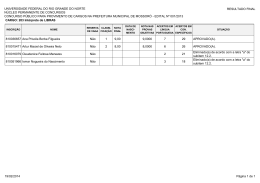
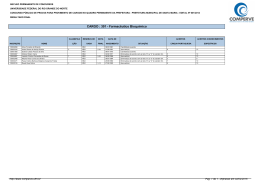
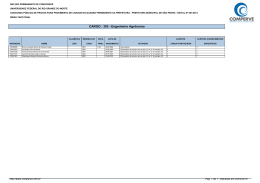
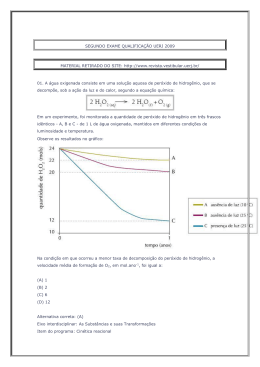
SEGUNDO EXAME QUALIFICAÇÃO UERJ 2013 MATERIAL RETIRADO DO SITE: http://www.revista.vestibular.uerj.br/ 01. Um produto industrial consiste na substância orgânica formada no sentido direto do equilíbrio químico representado pela seguinte equação: A função orgânica desse produto é: (A) éster (B) cetona (C) aldeído (D) hidrocarboneto Alternativa correta: (A) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Funções químicas Subitem do programa: Classificação e nomenclatura das substâncias orgânicas e inorgânicas Objetivo: Identificar a função de uma substância orgânica. Comentário da questão: Na equação química, o produto orgânico formado no sentido direto tem a seguinte fórmula estrutural: O grupamento funcional desse composto é: Esse grupamento é característico dos compostos que pertencem à função orgânica éster. Cabe mencionar que o segundo produto formado na equação é a água, uma substância inorgânica. Percentual de acertos: 48,15% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ________________________________________________________________________ 02. Em uma das primeiras classificações periódicas, os elementos químicos eram organizados em grupos de três, denominados tríades. Os elementos de cada tríade apresentam propriedades químicas semelhantes, e a massa atômica do elemento central equivale aproximadamente à média aritmética das massas atômicas dos outros dois. Observe as tríades a seguir: Com base nos critérios desta classificação, a letra X corresponde ao seguinte elemento químico: (A) O (B) As (C) Se (D) Po Alternativa correta: (C) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: Elementos químicos Subitem do programa: Massa atômica, número atômico, isotopia; classificação periódica, propriedades periódicas Objetivo: Identificar elemento químico com base na sua posição em tabela de classificação periódica. Comentário da questão: Na tríade que contém o elemento X, as massas atômicas do enxofre (S) e do telúrio (Te) são iguais a 32 e a 127,5, respectivamente. A média aritmética dessas duas massas equivale a: Os elementos químicos cujas massas atômicas mais se aproximam de 79,75 são o selênio (Se), com massa igual a 79, e o bromo (Br), com massa igual a 80. Entre esses dois elementos, porém, o selênio é aquele que apresenta propriedades químicas semelhantes ao enxofre e ao telúrio, sendo sua configuração eletrônica da camada de valência igual a ns2np4. Logo, considerando os critérios dessa antiga classificação periódica, a letra X corresponde ao Selênio (Se). Percentual de acertos: 89,37% Nível de dificuldade: Fácil (acima de 70%) ________________________________________________________________________ 03. A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria. Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons. A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a: (A) 0,5 (B) 1,0 (C) 1,5 (D) 2,0 Alternativa correta: (B) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: Elementos químicos Subitem do programa: Massa atômica, número atômico, isotopia Objetivo: Identificar a razão entre as cargas elétricas de núcleos de isótopos. Comentário da questão: Prótons são partículas eletricamente carregadas do núcleo, e isótopos são átomos de um mesmo elemento que possuem igual número de prótons. Logo, a razão entre as cargas elétricas de dois isótopos é igual a 1. De maneira alternativa, conhecendo o valor do número de massa e do número de nêutrons, o isótopo 54Fe possui 54 – 28 = 26 prótons, e o isótopo 56Fe possui 56 – 30 = 26 prótons. Logo, a razão entre o número de prótons é igual a 1. Percentual de acertos: 51,73% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ________________________________________________________________________ 04. Aminofenóis são compostos formados pela substituição de um ou mais átomos de hidrogênio ligados aos carbonos do fenol por grupamentos NH2. Com a substituição de apenas um átomo de hidrogênio, são formados três aminofenóis distintos. As fórmulas estruturais desses compostos estão representadas em: (A) (B) (C) (D) Alternativa correta: (D) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Funções químicas Subitem do programa: Classificação e nomenclatura das substâncias orgânicas e inorgânicas; isomeria Objetivo: Descrever as fórmulas estruturais dos aminofenóis. Comentário da questão: Substituindo-se apenas um átomo de hidrogênio do fenol por um grupo NH2, formam-se três compostos distintos: Como a cadeia carbônica é numerada de forma que os grupos ligantes apresentam os menores índices, as seguintes fórmulas estruturais correspondem aos mesmos compostos: Percentual de acertos: 62,52% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ________________________________________________________________________ 05. Em um reservatório contendo água com pH igual a 7, houve um descarte acidental de ácido sulfúrico. Em seguida, foi adicionada uma determinada substância de caráter básico, em quantidade suficiente para neutralizar a acidez. O gráfico que representa o comportamento do pH durante esse processo é: (A) (B) (C) (D) Alternativa correta: (C) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Equilíbrio químico Subitem do programa: Perturbações; acidez e basicidade Objetivo: Descrever graficamente a variação de pH da água em função da adição de ácidos e bases. Comentário da questão: A adição de ácido acarreta a redução do pH. Como o pH inicial da água é igual a 7, com a adição do ácido, o pH passa a ter valores menores que 7. Com a adição da base, ocorre a elevação do pH. Essa elevação se dá até a neutralização da quantidade de ácido adicionada, de forma que o pH retorna a 7. Percentual de acertos: 67,80% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) _________________________________________________________________________ 06. Dois balões idênticos são confeccionados com o mesmo material e apresentam volumes iguais. As massas de seus respectivos conteúdos, gás hélio e gás metano, também são iguais. Quando os balões são soltos, eles alcançam, com temperaturas internas idênticas, a mesma altura na atmosfera. Admitindo-se comportamento ideal para os dois gases, a razão entre a pressão no interior do balão contendo hélio e a do balão contendo metano é igual a: (A) 1 (B) 2 (C) 4 (D) 8 Alternativa correta: (C) Eixo interdisciplinar: As Substâncias e suas Transformações Item do programa: Gases ideais Subitem do programa: Evoluções e misturas gasosas Objetivo: Calcular a razão entre as pressões de dois gases ideais. Comentário da questão: Os dois gases têm comportamento ideal, logo aplica-se a equação de Clapeyron: Balão contendo gás hélio: Balão contendo gás metano: sendo P = pressão V = volume T = temperatura n = número de mols R = constante universal dos gases ideais Os balões apresentam volumes iguais: . As temperaturas no interior dos balões também são iguais: . Portanto: Igualando-se as equações: O número de mols de cada substância corresponde à seguinte relação: sendo m = massa. As massas molares do gás hélio e do gás metano são, respectivamente, 4 e 16 g/mol. Como as massas de ambos os gases são iguais, têm-se: Substituindo-se os valores: Percentual de acertos: 26,97% Nível de dificuldade: Difícil (abaixo de 30%) __________________________________________________________________________ 07. Substâncias que contêm um metal de transição podem ser oxidantes. Quanto maior o número de oxidação desse metal, maior o caráter oxidante da substância. Em um processo industrial no qual é necessário o uso de um agente oxidante, estão disponíveis apenas quatro substâncias: FeO, Cu2O, Cr2O3 e KMnO4. A substância que deve ser utilizada nesse processo, por apresentar maior caráter oxidante, é: (A) FeO (B) Cu2O (C) Cr2O3 (D) KMnO4 Alternativa correta: (D) Eixo interdisciplinar: Os Constituintes Fundamentais da Matéria Item do programa: Íons e moléculas Subitem do programa: Ligações químicas Eixo interdisciplinar 2: As Substâncias e suas Transformações Item do programa 2: Reações químicas Subitem do programa 2: Oxirredução Objetivo: Discriminar substância com maior número de oxidação. Comentário da questão: Com base na Classificação Periódica dos Elementos, os números de oxidação do O e do K são –2 e +1, respectivamente. Sabendo que a soma das cargas nas substâncias é igual a zero, calculam-se os números de oxidação dos demais elementos em cada substância: O metal de transição de maior número de oxidação é o Mn (+7). Assim, a substância de maior caráter oxidante é o KMnO4. Percentual de acertos: 51,09% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) ______________________________________________________________________
Download