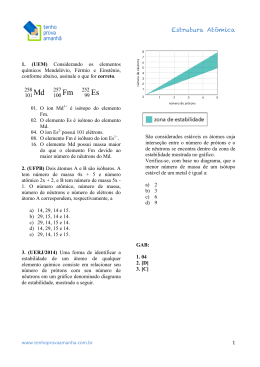
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO MANANHÃO Campus Bacabal Diretoria de Desenvolvimento de Ensino Departamento de Educação Superior de Tecnologia Curso de Licenciatura Plena em Química Disciplina: Química Geral I (60/10h) Ministrante: Prof. M.Sc. Maron Stanley Silva Oliveira Gomes LISTA DE EXERCÍCIOS – CONCEITOS FUNDAMENTAIS 1. Qual a massa e a carga dos prótons, nêutrons e elétrons? Supondo os elétrons com massa unitária, qual a massa relativa de prótons e nêutrons? 2. Cite alguns modelos atômicos antes de Rutherford. Qual o significado da palavra átomo? Por que ela perdeu o sentido original? O que significa fissão e fusão nuclear? 3. Descreva a experiência de Rutherford e explique suas conclusões. 4. O que significa isótonos e isóbaros? Exemplifique. 5. Pesquise as várias aplicações dos isótopos radiativos na nossa sociedade. 6. Descreva os efeitos maléficos da radiatividade no ser vivo. Pesquise o que aconteceu com os envolvidos no acidente de Goiânia-GO (1987); na usina de Chernobyl na Ucrânia e em Hiroshima no Japão. Quais os locais em Picos que fazem uso de isótopos radiativos? Informe-se sobre os procedimentos de segurança utilizados. 7. Quais as partículas emitidas durante a fissão nuclear? Pesquise a carga, a massa e o poder de penetração destas partículas. 8. Por que a espoleta da bomba de hidrogênio é a bomba atômica? 9. O que são radiações eletromagnéticas? Mostre as várias regiões do espectro eletromagnético. Pesquise as freqüências das rádios AM e FM de Picos e calcule suas energias. 10. O que são famílias radiativas? Como descobrimos a que família pertence determinado isótopo radiativo? 11. Como se comporta a relação prótons/nêutrons com o aumento do número atômico para os isótopos estáveis? Por que os prótons não se repelem no interior dos núcleos se apresentam carga elétrica de mesmo sinal? 12. Qual o significado da meia-vida de um isótopo radiativo? Explique o processo de datação pelo carbono-14. 13. Descreva o modelo atômico de Dalton e cite onde ele ainda hoje é usado. 14. Quantos tipos de elementos químicos existem até o momento? 15. Todos os átomos são constituídos de prótons e de elétrons. O que faz um átomo ser diferente do outro? 16. Qual a ligação existente entre número de massa e massa atômica? 17. Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb5(VO4)3Cl. Determine: a) a porcentagem em massa de vanádio nesse mineral; b) a massa em gramas de vanádio numa amostra que contém 2,4x1024 átomos de cloro. 18. A soma dos números de nêutrons de três átomos J, L e M é 88, enquanto a soma dos números de prótons é 79. Sabe-se ainda que L tem 30 nêutrons, J e L são isótopos, L e M são isóbaros e J e M são isótonos. Calcule o número atômico e o número de massa de cada um deles. 19. Mostre a contribuição do modelo de Bohr para construção do modelo atômico atual. Por que o elétron não cai no núcleo? 20. O que significa orbital no contexto do modelo de Schrödinger? 21. O que descrevem os números quânticos n, l e m? Qual a variação permitida para cada um destes números? Por quê? 22. A energia eletrônica pode ser ordenada para cada átomo. O diagrama de Pauling fornece um modo simplificado de deduzir a configuração eletrônica que é válida para a maioria dos casos. Monte o diagrama de Pauling. Prof. Maron Gomes Página 1 23. Conceitue o princípio de exclusão de Pauli e a regra de Hund. 24. O que é espectroscopia? 25. O que são radiações eletromagnéticas? Mostre as várias regiões do espectro eletromagnético com suas respectivas energias. 26. Nossos olhos enxergam radiação eletromagnética, chamada luz visível, cuja freqüência está no intervalo de 4,3 x1014 (luz vermelha) até 7,1 x10 14 (luz violeta). Calcule os comprimentos de onda da luz vermelha e luz violeta. 27. Em 1,0 s, uma lâmpada que produz 25 J de energia por segundo, em certa região do espectro, emite 5,5 x 1019 fótons de luz nesta região. Qual o comprimento de onda da luz emitida? (Resp. 437 nm) 28. Calcule o comprimento de onda da radiação emitida por um átomo de hidrogênio quando um elétron faz uma transição entre os níveis com n2=3 e n1=2. (Resp = 657 nm) 29. Faça a conversão de comprimento de onda para número de onda (em cm-1): a) 600 nm; b) 450 nm, c) 900 nm 30. Faça a conversão de número de onda para comprimento de onda (em nm): a) 1560 cm-1; b) 5250 cm-1, c) 10.000 cm-1. 32. O que é defeito de massa? 33. Explique a equação que é diretamente relacionada com a energia de ligação nuclear. 34. Explique a estabilidade do núcleo atômico em virtude da existência de prótons (cargas positivas). 36. Considere a mistura de pó de enxofre e limalhas de ferro. a) Cite dois métodos para separar os componentes do sistema. b) Após aquecimento incessante da mistura não foi possível à separação por imantação. Explique o fato. 37. As densidades do alumínio, do ferro e do cobre são, respectivamente, 2,7g/cm 3, 7,86 g/cm3 e 8,9g/cm3. Considere os dados da tabela abaixo e responda os itens que seguem. Densidade de alguns líquidos a 20°C em g/cm3 Água 1,00 Álcool 0,79 Óleo 0,83 Mercúrio 13,6 a) Utilizando os líquidos tabelados seria possível a separação dos três metais? Justifique. b) Ao colocar um cubo maciço de ferro de massa 62,88 g em cada um dos líquidos que massa dos mesmos será deslocada? E se o volume dos líquidos fosse o dobro? c) Represente pictoricamente o sistema formado por cubos de todos os metais indicados e por 10 mL de água, 60 mL de álcool, 20 mL de óleo e 20 mL de mercúrio adicionados nesta seqüência? Quantas fases apresenta o sistema? d) Qual a densidade do sistema constituído somente pelos líquidos na quantidade indicada na questão anterior? 38. Em uma aula de Química, um professor propôs aos seus alunos a produção de água do mar artificial, dispondo para eles água destilada e diversos sais. Após a obtenção da água do mar artificial, os alunos foram desafiados a separar a mistura, para isso estão disponíveis todos os materiais necessários exceto condensador. a) Que método deve ser utilizado para este fim? Esquematize o método proposto. b) Indique as transformações físicas que ocorrem durante todo processo e os meios utilizados para que as mesmas ocorram. c) Um aluno teve a idéia de simplesmente ferver a água, e durante este processo verificou-se a precipitação de sal. O procedimento purificou a água? Justifique. Que afirmação pode ser feita sobre a solução considerando o fato da precipitação de sal. 39. Em um béquer contendo água colocou-se 10 mL de acetona, 10 mL de óleo comestivel, 15 mL de gasolina comum, 5 g areia, dois cubos de gelo e duas lâminas de aço. Sobre o sistema formado indique: a) o número de fases e de componentes. Prof. Maron Gomes Página 2 b) o número de misturas homogêneas no sistema. c) um esquema de separação dos componentes possíveis de separar sem aquecimento. 40. 5 g de ferro foram colocados em uma proveta de 25 mL contendo 10 mL de água. Sabendo que a densidade do ferro é 7,86 g/cm3, responda: a) Qual volume (em mL) indicado na proveta após a adição da amostra de ferro? b) Que volume de água (em mL) pode ser colocado em um cubo de 5 cm de aresta e massa de 393 g? 41. Um cation bivalente apresenta 54 eletrons. Qual o nº atomico do elemento que formou o cation? 42. Um anion trivalente apresenta 36 eletrons. Qual o nº atomico do elemento original? 43. Um ion binegativo apresenta 54 eletrons e 76 neutrons. Qual a massa atomica do elemento original? 44. Determine o numero de eletrons de cada uma das especies abaixo: a) PO43- b) SO4-2 c) H2CO3 d) NH4+ Prof. Maron Gomes Página 3
Download