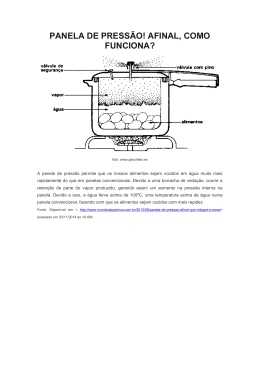
Processo Seletivo de Formadores da SEEDUC 2015 Material II de Apoio para a Fase de Prova-Aula Especialidade: Área das Ciências da Natureza (com formação em Química) Recorte do material com orientações para os Professores – Atividades de Química Orientações para Planos de Aulas Integradas (OPAI) da Área das Ciências da Natureza: Detalhamento de Atividades Exemplares da Disciplina de Química, referente ao 1º bimestre do 1º ano do Ensino Médio 1 DETALHAMENTO DAS ATIVIDADES DE QUÍMICA Atividade 1: O que é química? Resumo: esta atividade mobilizará os jovens para o estudo da disciplina, por meio de leitura e análise de diferentes textos e do confronto do senso comum com as informações científicas. Foco: pensamento crítico e comunicação por meio da leitura e escrita na disciplina. Objetivo: mobilizar os jovens para o estudo da disciplina. Duração prevista: 2 tempos, para 3 etapas Material/recursos: os vídeos coleção Química é vida, disponível em www.youtube.com/watch?v=vDo6cKKuFGc&NR=1 e Ano Internacional da Química (2011), disponível em www.youtube.com/watch?v=9PFFgRnM9qg&feature=related; atividade da página 14, capítulo 1 do livro Química – projeto Voaz, ed. Scipione, escrito por Eduardo Mortimer e Andréia Machado, e texto da página 21 do mesmo livro. ender, identificando, comparando e estabelecendo relações importantes com o que Gestão da aula Um aluno motivado não só está atento ao que é ensinado, mas, ainda, fará um esforço para compre já sabe. As questões sensibilizadoras desta atividade, cujo papel aqui é justamente deixar o aluno atento e mobilizado, o auxiliarão a estabelecer relações da Química com fatos do cotidiano. Desenvolvimento 1ª etapa: questões sensibilizadoras Iniciar a aula com duas questões sensibilizadoras. 1. Em que situações você se depara com a palavra química? 2. Que significado atribui a essa palavra em cada caso? Os alunos devem responder às questões individualmente, no caderno. Em seguida, em grupos de 4 alunos, as respostas devem ser debatidas. Cada grupo compartilha com a classe uma situação e o significado que o termo “química” suscita. 2 2ª etapa: divulgação da química Fazer uma lista-síntese, no quadro, dos significados que a palavra assume. Passar um dos vídeos indicados acima ou propor a análise do rótulo de um produto químico. Selecionar entre os que ressaltem a imagem equivocada e muitas vezes pejorativa da química (distribuir rótulos diferentes, encontrados na Internet, para cada grupo de 4 alunos). Na coleção Química – projeto Voaz (cap. 1, p. 14), há um exemplo interessante de um creme repelente à base de citronela. Apresentar o rótulo (pode ser um impresso ou uma projeção) e pedir para os alunos responderem à questão: qual o significado da palavra química presente no rótulo? É possível relacioná-lo com os itens da listasíntese realizada? Organizar uma discussão na classe que incentive os alunos a criticarem o significado das expressões “sem química” e “100% natural”. Essas expressões são frequentemente encontradas nos rótulos como sinônimo de qualidade. Verificar se os alunos reconhecem que o uso da palavra química no cotidiano está associado a algo ruim, perigoso (percepção que pode ter aparecido no quadro-síntese dos significados da palavra) e se eles percebem que esse exemplo de rótulo explora esse preconceito com a química. 3º etapa: formalização conceitual Gestão da aprendizagem Grifar as ideias centrais para um objetivo da leitura é uma habilidade que, para ser desenvolvida, deve ser realizada várias vezes. Por isso, incentive os alunos a fazê-lo na leitura do texto “O que a química estuda”. Depois peça que um aluno mostre para os demais as partes do texto que foram grifadas por ele e incentive a comparação e justificativas entre as decisões desse alunos com os outros. Solicitar aos alunos a leitura do texto “O que a química estuda?”, que se encontra na página 21, capítulo 1, do livro coleção Química – projeto Voaz. Os alunos terão uma 3 apresentação do que a disciplina estuda, abordando a química como o estudo das propriedades, constituição e transformações de substâncias e materiais. Nessa atividade, é importante ouvir dos alunos o que eles entendem por transformações químicas, composição da matéria e propriedades dos materiais. Assim, pode-se adiantar para eles que esses conceitos serão objeto de estudo ao longo do ano. Na ocasião em que os conteúdos forem tratados, utilizar os conceitos e termos apontados por eles como um meio de mobilização. Atividade 2: Propriedades da matéria Resumo: os materiais são classificados e têm aplicações relacionadas a suas propriedades físicas e químicas (transformações). O conhecimento químico está relacionado à descrição dessas propriedades. As atividades descritas a seguir iniciam o estudo da química com a investigação das propriedades da matéria, o que é fundamental para a compreensão da disciplina e leva o aluno ao desenvolvimento de uma série de habilidades pertinentes à investigação em ciência, ao trabalho no laboratório, à análise de dados, fundamentais para o desenvolvimento de um aluno protagonista. Foco: gestão de informações, gestão de processos e resolução de problemas. Objetivo: Compreender que as propriedades físicas frequentemente são utilizadas para identificar e distinguir as substâncias das misturas. Duração prevista: 10 tempos, para 7 etapas Material/recursos: panelas (podem ser figuras, ou imagens obtidas por pesquisa na Internet, se a aula for realizada na sala de computação, ou panelas trazidas pelos alunos de casa); sólidos maciços (como paralelepípedos retos) de dois materiais distintos (metal, plástico, madeira) em três tamanhos diferentes (se possível, 6 no total por grupo de 4 alunos), ou líquidos distintos (água, álcool, óleo) em volumes diferentes em provetas (lembrando de descontar a massa das provetas secas); instrumentos para medidas: balança, régua ou fita métrica, trena, paquímetro, calculadora; provetas, água, álcool (96%), cubos de gelo; seringa de plástico ou vidro (de vidro funciona melhor), vidraria graduada, água, alguns objetos sólidos (que entrem em alguns dos frascos e em outros não), erlenmeyer com bexiga adaptada na boca (ou frasco 4 equivalente) e lamparina, ou vela; papel milimetrado, régua e o aplicativo http://rived.mec.gov.br/atividades/concurso2006/identificandosubstancias/atividade. swf; béquer, tubos de ensaio, termômetros, gelo, sal, água, proveta, balança. Gestão da aula Toda aula deve ter começo, meio e fim, para que os alunos vejam sentido no estudo dedicado à disciplina. Observe se isso está claro em cada proposta de aula desta OPA! Na aula, propomos que a pauta seja exposta no quadro e que os 5 minutos finais sejam dedicados a verificar se o proposto foi ou não cumprido. Os alunos devem identificar o que favoreceu ou prejudicou o cumprimento da pauta. Se, eventualmente, o seu planejamento foi inadequado, é interessante que isso também seja compartilhado com a classe. Desenvolvimento 1ª etapa: critérios para a seleção de materiais (2 tempos) Organize a sala em pequenos grupos de até 4 alunos. Proponha uma atividade para despertar o interesse em conhecer as propriedades dos materiais e as implicações para a compreensão dos objetos que nos cercam. A ideia desta etapa é levantar quais as características que tornam um material adequado para determinada aplicação. Por exemplo, uma panela. Coloque a seguinte questão para os grupos: “Quais seriam as propriedades adequadas para os materiais constituintes de uma panela”? Peça aos alunos que anotem um relato da discussão do grupo. Explique a importância das propriedades nas aplicações da panela. Promova um pequeno debate e faça um resumo no quadro das principais características levantadas, ouvindo as explicações dos alunos. É importante que os momentos de síntese no quadro também sejam um momento de aprendizado de síntese para os alunos, que devem fazer suas anotações no caderno. Pode-se orientar essa anotação com algumas estratégias úteis: ao final da aula, peça para alguns alunos lerem o que anotaram de mais importante e para outros complementarem; procure dar contribuições até chegar a um modelo completo de anotação; 5 na aula seguinte, solicite que os alunos retomem o que foi discutido a partir da anotação do caderno (escolher um aluno). Peça para outros alunos complementarem, chame atenção para os diferentes exemplos de anotações eficientes e para as lacunas e os pontos essenciais que não podem faltar na anotação daquela aula; solicite que os alunos troquem os cadernos (em duplas) e que, depois de analisarem as anotações do colega, discutam e reelaborem as suas próprias anotações. Para essa prática, é interessante que as duplas se alternem em cada situação. Apresente algumas panelas para os alunos (podem ser figuras ou imagens obtidas por pesquisa na Internet, se a aula for realizada na sala de computação, ou panelas trazidas de casa). Cada grupo deve analisar os materiais que constituem a panela, considerando se respondem às características gerais desejáveis para uma panela e se apresentam propriedades que não foram pensadas pela classe. Solicite que o grupo produza um breve relatório, descrevendo a panela e caracterizando os materiais que a compõem, destacando suas propriedades. Muitas observações diferentes podem aparecer, e é importante não limitar a criatividade e a análise dos alunos. Ao mesmo tempo, é função do professor direcionar a discussão para o seu foco: propriedades dos materiais que sejam úteis para o uso comum do utensílio panela. Verifique, a seguir, alguns exemplos de propriedades que podem aparecer nos relatórios dos alunos. cabos de materiais bons isolantes térmicos e resistentes ao calor (facilita na hora de pegar a panela, evita que o cabo derreta); corpo da panela feito de material bom condutor de calor e de alta temperatura de fusão (essencial para a principal função da panela, aquecer alimentos no fogão); os materiais não podem entrar em combustão nas condições de uso da panela (essa é uma propriedade química interessante); 6 os materiais não devem corroer, nem reagir com os alimentos (podendo causar alguma intoxicação); camada antiaderente no interior da panela (facilita limpeza). Além das observações esperadas pelos alunos, há estes detalhes sobre panelas que, se houver oportunidade ou interesse, podem ser debatidos na classe e compor um relatório final das observações sobre a panela que deve ser copiado pelos estudantes em seus cadernos: o fundo grosso da panela e sua função na troca de calor com o alimento; cuidados para não riscar a camada de teflon antiaderente; a dificuldade de transportar panelas com cabos de metal (uma moda das panelas de aço inox); a manutenção da temperatura do alimento nas panelas de barro (ideal para moquecas); a possibilidade da transferência de cátions ferro para o alimento nas panelas de ferro (em algumas condições pode acontecer com o cobre e o alumínio); a leveza das panelas de alumínio comparadas com as de ferro, aço ou cobre; o agrupamento de alguns materiais por características semelhantes, como metais resistentes ao calor e bons condutores térmicos. Perceba que a intenção da atividade não é esgotar todas as propriedades e nem se ater às que serão estudadas. A etapa pode ser finalizada com as formalizações a seguir. Escolhemos materiais para utensílios e outros dispositivos que utilizamos a partir de suas propriedades. Caracterizar a matéria (finalidade da química) é se ater a essas propriedades, além de diferenciar os materiais pelas suas propriedades intensivas. 7 Gestão da aprendizagem Os alunos anotaram alguma coisa em seus cadernos? O quê? Lembre-se de que cabe a você orientar o que eles devem registrar e explicar por que registrar essa ou aquela ideia ou relação. Com o passar do tempo, você pode perguntar a eles: do que está aqui no quadro ou no livro, o que vocês acham que deve ser anotado no caderno para ajudá-los a estudar depois dessa aula? Não há necessidade de se proceder sempre dessa forma, mas é uma metodologia prática de mostrar aos alunos a importância do caderno como objeto de registro do estudo e ajudá-los a desenvolver o seu próprio método de anotação e síntese. Nesta atividade, a lista final com as observações feitas por eles sobre o objeto panela, as observações antes e depois de cada experimento, as conclusões sobre os experimentos, as sínteses com conceitos aprendidos e os exercícios propostos serão os primeiros registros deste curso, aos quais eles podem retornar no decorrer do curso, a cada vez que uma das propriedades químicas for estudada ou solicitada nas aulas. Lembre-se: as competências de ler e escrever são o foco deste bimestre! 2ª etapa: densidade - laboratório (experimento investigativo com 2 tempos) Antes de iniciar a atividade prática propriamente dita, é importante discutir com os alunos orientações gerais para práticas em laboratório, considerando que: o ideal, por segurança, seria o aluno estar de avental (algodão, manga comprida), calçado fechado e calças; o aluno conheça muito bem a instrução proposta, pois em laboratório espera-se dele ainda mais autonomia; cada aluno receba um roteiro com as instruções por escrito, indicando o procedimento experimental e as questões para reflexão (o professor pode fazer a leitura coletiva do procedimento experimental, ensinar a utilizar uma aparelhagem ou vidraria específica, como uma balança, por exemplo, ou indicar o procedimento de segurança quando necessário); cada equipe receba o material indicado para o experimento, sendo as bandejas de plástico muito úteis para essa organização e separação de materiais por equipe; o professor e cada grupo precisa ter consciência quanto a minimização e prevenção na produção de resíduos; o professor faça uso de microescala em laboratórios de ensino de química. 8 Quanto aos experimentos sobre densidade, seus objetivos são: verificar se massa e volume são propriedades peculiares da matéria; conferir se existe uma relação entre massa e volume que caracterize as substâncias. Para a investigação, cada grupo deve dispor do material assinalado a seguir. Sólidos maciços (como paralelepípedos retos) de dois materiais distintos (metal, plástico, madeira) em três tamanhos diferentes (se possível, 6 no total, por grupo), para comparar resultados. É também possível realizar a experiência com líquidos distintos (água, álcool, óleo) em volumes diferentes em provetas (lembrando de descontar a massa das provetas secas). Instrumentos para medidas: balança, régua ou fita métrica, trena, paquímetro, calculadora. Gestão da aula Em aulas expositivas, ainda que dialogadas, e em aulas experimentais, os alunos precisam registrar os pontos importantes: um conceito novo, um procedimento, uma propriedade ou lei para consulta futura, um exercício exemplar para ser modelo na resolução de outros etc. Será que eles sabem o que anotar? Ou anotam tudo sem discriminar o nível de importância de cada coisa? Ensiná-los a anotar é também conteúdo de ensino. Para isso, faça paradas ao longo da aula e solicite que anotem isso ou aquilo conforme sua orientação. Organize uma pequena síntese da aula com eles e peça que registrem em seus cadernos. Use essa síntese como ponto de partida da próxima aula. Isso dá uma forcinha para a memória e mostra o sentido e a lógica do percurso de estudo que estão realizando. Para iniciar, solicite que a classe se divida em times com 4 alunos e, em seguida, distribua o Roteiro 1 para cada aluno e um bloco de madeira para cada grupo. A análise dos dados registrados deve incluir questões para discussão. Concluída parcialmente a análise dos dados (questões 1 e 2) , proponha um rápido debate para que se atinja um consenso a respeito das duas questões sugeridas. Procure incentivar os grupos a colocarem seus argumentos, principalmente se houver discordâncias. 9 Em seguida, solicite que os alunos respondam à questão número 3. Concluída a análise dos dados (questões 1, 2 e 3), proponha um rápido debate para que se atinja um consenso a respeito da questão 3, novamente incentivando os grupos a colocarem seus argumentos, principalmente diante de discordâncias. ROTEIRO 1 - DO ALUNO 1. Reproduza o quadro abaixo em seu caderno e registre nele o que é observado em cada etapa do experimento. Identifique o número da amostra, a medida da sua massa em g e a medida do seu volume em cm3. A tabela deve ter um número de linhas que permita anotar as medidas encontradas pelos demais times da turma. 2. Determine a massa, em gramas (g), do bloco de madeira que o time recebeu do professor. 3. Determine o volume do paralelepípedo reto (bloco de madeira), utilizando a expressão algébrica a seguir. Volume (cm3) = aresta x aresta x aresta 4. Preencha as demais colunas do quadro com as operações matemáticas indicadas (a soma massa + volume (m+V), a relação massa/volume (m/V), e o produto massa x volume (m x V)). Amostra massa (m) volume (V) 1 2 3 (g) (cm3) m+V m/V mxV Análise de dados Dê um tempo para que os times observem os dados coletados no quadro e, na sequência, convide cada grupo a resolver as questões a seguir. 1. Massa e volume são grandezas adequadas para descrever materiais? Caso contrário, para que servem? 10 2. Em alguma das três operações matemáticas envolvendo as grandezas de massa e volume pode-se verificar uma regularidade? É possível dizer que estamos caracterizando um material com essa operação? 3. O valor constante obtido na coluna m/V corresponde a uma propriedade conhecida como DENSIDADE. Observe os valores obtidos no quadro e tente explicar (fazer o registro no caderno) por que massa e volume são chamados de propriedades gerais e a densidade é conhecida como propriedade específica. Finalize a aula com a formalização dos conceitos de densidade, propriedades gerais e propriedade específica, indicando aos alunos que os registrem em seus cadernos. Aplicação do conhecimento Promova um tempo para os alunos resolverem exercícios, em dupla ou individualmente. Selecione um exercício mais significativo para resolver no quadro, indicando os conceitos envolvidos e detalhando os cálculos efetuados. Apresente também um exercício que contemple o gráfico “massa x volume” de uma substância qualquer, fornecendo uma explicação do conceito de densidade a partir desse gráfico, que mostra a relação direta entre as grandezas massa e volume. A seguir, estão alguns exercícios que podem ser projetados ou impressos para que os alunos os resolvam em sala de aula. 1. A tabela abaixo indica a densidade de algumas substâncias à temperatura ambiente. 3 Substância densidade (g/cm ) mercúrio ácido sulfúrico água ferro alumínio chumbo cobre ouro álcool metílico 13,546 1,841 1,00 7,86 2,702 11,3 8,90 19,3 0,79 11 Responda às questões: I. Qual das substâncias apresenta maior densidade? II. Se tivéssemos volumes iguais de ouro, cobre e chumbo, qual apresentaria menor massa? Explique sua resposta. III. Se tivéssemos massas iguais de ácido sulfúrico, mercúrio e água, os volumes seriam iguais? Explique sua resposta. IV. A densidade é uma constante física? V. A densidade pode ser usada para caracterizar uma substância? Explique sua resposta. 2. O gráfico a seguir representa a densidade de três substâncias arbitrariamente designadas como X, Y e Z. X 30 25 massa (g) 20 Y 15 10 Z 5 0 0 5 10 15 20 25 30 volume (mL) Julgue as afirmações abaixo em (V) verdadeiro ou (F) falso. I. ( ) A densidade da substância X é maior que a da substância Z. II. ( ) Nas mesmas condições de temperatura e pressão, massas iguais das substâncias X e Y ocupam o mesmo volume. III. ( ) A densidade aproximada da substância Y é de 0,5 g/mL. Expectativa de respostas 1. I. ouro; II. Ouro. Para volumes iguais de materiais diferentes, o material de maior densidade terá maior massa; III. Não, são materiais com densidades diferentes; IV. Sim; V. Sim, porém quando as densidades de duas substâncias são muito próximas, torna-se inconveniente o uso somente da densidade como propriedade física para distingui-las. 12 2. I. (V) (volumes iguais de substâncias diferentes; quanto maior massa, maior densidade, d = m/V); II. (F) (massas iguais de duas substâncias com densidades diferentes ocupam volumes diferentes); III (V) d = m/V = 5 g/ 10 mL = 0,5 g/mL. 3ª etapa: Densidade de misturas – Laboratório (experimento investigativo em 2 tempos) Nesta atividade experimental pretende-se que os alunos: compreendam que as misturas de substâncias apresentam densidades intermediárias a cada um dos componentes; conheçam as grandezas utilizadas para exprimir a composição de soluções, ou concentração (%v/v). Para a investigação, cada grupo deve dispor dos materiais: roteiro de laboratório, provetas, água, álcool (96%), cubos de gelo. Atenção, apesar de o álcool ser 96% em volume, para facilitar os cálculos, ele pode ser expresso como 100% (a experiência não justifica a utilização de etanol anidro que é muito mais caro, uma vez que serão preparadas misturas de água e álcool). No início da aula, mostre que o gelo flutua na água e afunda no álcool. Proponha aos alunos, distribuídos em quartetos, o seguinte desafio: Vocês devem preparar uma solução de água (d = 1 g/cm3) e etanol (d = 0,70 g/cm3) em que o gelo fique completamente submerso, mas sem afundar. Oriente os alunos que fica mais fácil preparar sempre 100 ml de solução. Pode ser sugerida uma composição para cada grupo. Em seguida, apresente ao aluno um roteiro de como preparar as soluções e como representar a sua concentração. Os alunos devem descrever suas observações e anotar os resultados para cada solução preparada. Em seguida, mostre a tabela abaixo e compare com os resultados dos alunos. 13 Composição (volume de etanol em Densidade de mistura 100 cm3 de mistura com água) 10,0 30,0 50,0 99,0 (g/cm3) 0,99 0,97 0,93 0,80 Formalize o conceito de densidade de mistura: Ao contrário das substâncias puras, as misturas não apresentam densidade característica. A densidade de uma determinada mistura (água e álcool, água e sal, ouro e cobre, entre outras) varia com a composição, isto é, com a composição de cada componente que a constitui. Aplicação do conhecimento Proponha aos alunos, em duplas ou individualmente, que resolvam o seguinte exercício: A coroa do rei Heirão é pura ou trata-se de uma mistura? Expectativa de respostas Densidade da coroa = 17,5 g/mL 14 Densidade do ouro é aproximadamente 20 g/mL Densidade da prata é aproximadamente 11 g/mL Densidade do cobre é aproximadamente 9 g/mL Portanto, a coroa do rei Heirão é uma mistura. 4ª etapa: estados de agregação da matéria: sólido, líquido e gás (2 tempos) Os objetivos desta atividade são: descrever o comportamento da matéria a partir de seus estados de agregação; estabelecer critérios que classifiquem um material em sólido, líquido ou gasoso; discutir as condições para que haja mudança de estado físico (fusão, sublimação, vaporização, condensação, solidificação). Os materiais necessários para que os objetivos sejam alcançados são: seringa de plástico ou vidro (de vidro funciona melhor), vidraria graduada, água, alguns objetos sólidos (que entrem em alguns dos frascos e em outros não), erlenmeyer com bexiga adaptada na boca (ou frasco equivalente) e lamparina. Gestão da aula A ideia é que, mesmo que algum aluno não conheça os termos específicos, ele consiga classificar os materiais a partir da descrição. Pode-se insistir na linguagem formal nos registros de aula, mas sem reprimir a informal dos alunos. Reserve cerca de 5 minutos iniciais da aula para solicitar aos alunos, organizados em grupos, que descrevam no caderno o que é um sólido, um líquido e um gás. Antes da discussão, o professor pode fazer as demonstrações a seguir, que evidenciam as características dos três estados da matéria: coloque um objeto sólido em um béquer e, em seguida, mostre que não é possível introduzi-lo num frascocom a boca mais estreita; despeje um volume fixo (cerca de 50 mL) de líquido (água) em frascos de formatos diferentes (se graduados, melhor); 15 com uma seringa, mostre a compressão e a expansão de um gás, com o êmbolo voltando para a posição inicial; e aqueça, com auxílio de uma lamparina ou vela, um frasco com uma bexiga adaptada na boca. Neste experimento, pode-se observar a dilatação do gás. Após as demonstrações, solicite aos alunos que reelaborem a sua descrição. Promova o debate, com a apresentação das descrições. Elabore uma síntese no quadro, chamando a atenção quando a mesma característica é descrita de maneira e com exemplos diferentes. Mostre que um termo pode substituir um conjunto de descrições. Exemplo: o termo fluido para um líquido pode substituir: escorre, “não dá para pegar”, “posso atravessar”, não tem forma definida, “se acomoda no frasco”, assim por diante. Alguns conceitos como pressão e dilatação devem aparecer no debate. Forneça aos alunos a definição conceitual, sem esgotar o assunto ou apresentar fórmulas algébricas. 5ª etapa: mudança de estado de agregação – objeto de aprendizagem (2 tempos) O objetivo é levar os alunos a conhecerem e interpretarem curvas de aquecimento de substâncias puras. A atividade deve ser realizada em sala de informática, com os seguintes recursos: objeto de aprendizagem “Identificando Substâncias”, disponível em http://rived.mec.gov.br/atividades/concurso2006/identificandosubstancias/atividade. swf, papel milimetrado, lápis e régua. Utilize o aplicativo previamente para poder orientar os alunos. É recomendável trabalhar offline, instalando previamente o aplicativo nos computadores para não depender do funcionamento da rede. Organize a classe em duplas, por computador, distribua o Roteiro 2 para cada aluno e se assegure de que todas as seis substâncias sejam analisadas com a utilização do simulador sugerido acima. Com esse recurso, o aquecimento e a respectiva curva são realizados em segundos. De posse dos gráficos, os alunos escrevem quais as características que conseguem identificar na curva de aquecimento. 16 Nesse momento, não há necessidade de usar modelos atômicos para explicar as observações. Os experimentos e as atividades servem para caracterizar macroscopicamente a matéria, suas características e comportamentos. A partir de um grande número de informações experimentais é que se partirá para um modelo de constituição da matéria. Como apoio, sugerem-se as obras: Química – na abordagem do cotidiano, v. 1, de Tito e Canto, ed. Moderna; Química – ser protagonista, v. 1, coordenado por Júlio Cezar F. Lisboa, ed. SM. Na sala de computação, os alunos podem trabalhar em duplas. ROTEIRO 2 DO ALUNO Analise duas substâncias, lembrando que o foco da atividade não é identificar as substâncias, mas sim estudar as curvas de aquecimento. A dupla escolhe a amostra, sua respectiva massa, a temperatura inicial e o tempo de aquecimento. Quanto mais informações o gráfico fornecer melhor. Após escolhida a condição mais apropriada, reproduza a curva de aquecimento, não esquecendo as escalas e as grandezas representadas em cada eixo. Atente, durante o aquecimento, para o estado físico do material representado no béquer. Essa informação pode ser representada no gráfico. Descreva o estado físico do material em cada região do gráfico. Caso a equipe tenha dúvidas, repetir o gráfico nas mesmas condições. Reserve os 15 minutos finais da aula para formalizar o que foi observado pelos alunos. Para isso, projete a curva de aquecimento de uma das substâncias envolvidas na atividade e conceitue as regiões de aquecimento (calor sensível) e as de mudança de estado (calor latente). Aproveite para apresentar (ou retomar) o princípio da conservação da energia, indicando que o calor transferido da fonte de aquecimento para a substância fica contido na substância (em outra forma de energia). 17 Aborde na discussão os patamares, as temperaturas de ebulição e fusão constantes (e seus significados). Indique que a temperatura de fusão e ebulição de uma substância são propriedades específicas e intensivas. Vale ressaltar que o calor necessário (e no caso de uma fonte de aquecimento constante, o tempo) para aquecer a substância ou proceder à completa mudança de estado depende da massa envolvida e do tipo de substância. A comparação dos gráficos obtidos pelos alunos para massas iguais de substâncias diferentes ou massas diferentes da mesma substância favorece o processo de análise. Reforce a importância de os alunos terem uma curva de aquecimento com todas as suas regiões bem descritas e comentadas, como síntese desse conteúdo no caderno. Nesse momento, não há necessidade de usar modelos atômicos para explicar as observações. Aplicação do conhecimento Apresente o exercício 1 e oriente que não basta que o aluno responda se a afirmativa é verdadeira ou falsa, mas sim que faça o registro no caderno da justificativa de cada escolha. 1. A Química é uma ciência que estuda fundamentalmente a composição, as propriedades e as transformações das substâncias químicas, das misturas e dos materiais formados por essas substâncias. Para identificá-las, os químicos utilizam um conjunto de propriedades específicas com objetivo de diferenciá-las 18 experimentalmente de uma mistura. O gráfico representa a curva de aquecimento de uma determinada amostra de material sólido em função do tempo. Uma análise dessas informações e da curva de aquecimento dessa amostra de material permite afirmar (marque (V) para afirmativa verdadeira e (F) para afirmativa falsa): I. ( ) No tempo t2 coexistem sólido e líquido. II. ( ) A temperatura T2 representa o ponto de ebulição da substância. III. ( ) No intervalo de tempo t3 a t4, os estados líquido e vapor da substância coexistem a uma temperatura constante. IV. ( ) A curva de aquecimento mostra que a substância não é pura, mas, sim, uma mistura homogênea simples. V. ( ) O tempo t1 representa o início da vaporização da substância. VI. ( ) No intervalo de tempo t2 a t3, a substância se encontra no estado líquido a uma temperatura que varia de T1 a T2. VII. ( ) As propriedades específicas utilizadas para identificação das substâncias químicas dependem da quantidade da amostra utilizada. Expectativa de respostas 1. I (F); II (V); III (V); IV (F); V (F); VI (V); VII (F) Alguns exercícios de análise de curvas de aquecimento ou de tabelas contendo temperaturas de ebulição e fusão podem ser trabalhados em sala ou em Estudos Orientados, com posterior discussão das dúvidas. Bons exemplos de exercícios estão nos livros Química – na abordagem do cotidiano, de Tito e Canto, ed. Moderna (página 47), e Química – ser protagonista, coordenado por Júlio Cezar F. Lisboa, ed. SM. (páginas 50 a 57). Após os exercícios, vale ressaltar para os alunos que: 19 as propriedades específicas (densidade, temperatura de fusão, temperatura de ebulição) são úteis na identificação e caracterização de substâncias e misturas, ou seja, da matéria; as propriedades levantadas na atividade da panela, indicando que a busca por materiais adequados para ferramentas e outros utensílios vem de tempos remotos, praticamente inerente à humanidade. Formalize para os alunos e peça que registrem em seus cadernos: A química é a ciência que sistematiza essa caracterização da matéria, a partir de propriedades químicas (aquelas que envolvem transformação da matéria) ou físicas (as que não envolvem transformação da matéria). 6ª etapa: mudança de estado de agregação, substâncias puras e misturas. Laboratório (experimento investigativo em 2 tempos) Os alunos vão comparar as curvas de resfriamento da água com uma solução diluída de água e sal para reconhecerem que as curvas de aquecimento (e resfriamento) de misturas apresentam comportamento distinto das substâncias puras durante a mudança de estado. A atividade requer béquer, tubos de ensaio, termômetros, gelo, sal, água, proveta, balança. A coleção Química – projeto Voaz, v. 1, páginas 45 a 47, oferece a descrição de uma montagem simples e interessante para o experimento. Vale preparar o roteiro de laboratório a partir dessa descrição, pois as questões estão bem elaboradas, o procedimento experimental está claro e possibilita a comparação entre as curvas de resfriamento de uma substância pura e uma mistura. É preciso tomar cuidado para que a solução no tubo de ensaio contenha bem menos sal do que a mistura refrigerante. Além da realização do experimento e da construção das curvas de resfriamento, convém selecionar questões para discussão em sala de aula. 20 Ao final, elabore com os alunos uma síntese coletiva, na qual é preciso ressaltar a diferença entre as curvas de aquecimento e resfriamento de substâncias puras e misturas. Pode-se comentar sobre as misturas azeotrópicas e eutéticas e dar exemplos. Nesse momento, vale a pena definir substância como porção de matéria que apresenta propriedades específicas e salientar a temperatura de fusão e ebulição como um parâmetro adequado (mas não único, nem infalível) para se distinguirem misturas homogêneas de substâncias puras. 7ª etapa: solubilidade: uma propriedade específica (4 tempos) O estudo da solubilidade é o nosso próximo passo. Essa propriedade também está relacionada a uma série de materiais do cotidiano como as demais propriedades que desenvolvemos até o momento. O objetivo é que os alunos aprendam a: conceituar misturas homogêneas e heterogêneas; conceituar soluto e solvente; identificar a solubilidade como uma propriedade específica das substâncias; interpretar curvas de solubilidade em função da temperatura, resolvendo problemas utilizando esses gráficos. Gestão da aula Ler exige concentração e saber destacar o que é importante no texto. Aqui propomos novamente a ação de grifar alguma parte do texto, ou seja, destacá-la das demais partes. Lembre os alunos disso, orientando-os a retomar a atividade “Selecionar o mais importante, grifar e anotar”, do Guia do investigador de conhecimentos, páginas 32 e 33. Ter em mente o que se deseja obter do texto ou qual tarefa ajuda a selecionar o que deve ser grifado no texto. Para apresentar o conceito de solução, de soluto e solvente, a proposta inicial é a leitura individual do aluno do texto 7, páginas 49 e 50, da coleção Química – projeto Voaz, v. 1. Em seguida, em grupos de 4 a 5, os alunos respondem às questões 21 apresentadas na página 51 do mesmo material. As respostas devem ser dadas por escrito. Promova uma discussão coletiva, em que devem ser diferenciadas as soluções (misturas homogêneas) de misturas heterogêneas, recorrendo às recordações dos alunos. Na ocasião, faça também uma ampliação da composição atmosférica e dos oceanos. Como exemplos, mencione o ar com poeira, ou fuligem de caminhão, ou ainda a água do mar com areia em suspensão. Como diferenciar essas situações daquelas descritas no texto? Durante a discussão, lembre-se de fazer a síntese das conclusões no quadro e de indicar para os alunos anotarem em seus cadernos. Nessa síntese da discussão, utilize os termos: soluto, solvente, solução, solução saturada, solução insaturada. Os alunos devem ter clareza desses termos e, de preferência, anotar as definições no caderno. Para a aula seguinte, a sugestão é deixar a seguinte pergunta para os alunos: “Quantas colheres (sopa) rasas de sal você acha que é possível dissolver em um copo com água (200 ml)”? Faça uma estimativa. Na próxima aula, o foco é a análise de curvas de solubilidade de algumas substâncias em função da temperatura. Gestão da aprendizagem Ler gráficos e tabelas é uma habilidade importante e que foi solicitada nas atividades anteriores. Antes de iniciar essa atividade verifique com os alunos as dificuldades que eles identificam para ler esse tipo de texto. Proponha que os que sabem ler trabalhem em grupo com outros de modo que todos possam aprender. Ao final, avalie com eles se as dificuldades foram minimizadas e peça que destaquem uma aprendizagem importante. Lembre-se: colaboração e liderança são duas competências da matriz deste projeto e que podem ser trabalhadas nesta próxima atividade. Entregue uma cópia do gráfico, a seguir, para cada aluno. 22 Solicite que os alunos colem o gráfico no caderno e que nele também reproduzam o quadro a seguir, a fim de completá-lo com os dados do gráfico. Solubilidade na temperatura indicada (em g/100 g de água) Material 20 0C 40 0C 60 0C 80 0C NaCl (cloreto de sódio) Pb(NO3)2 (nitrato de chumbo) KNO3 (nitrato de potássio) Cs(SO4)2 (sulfato de césio) Solicite que os alunos, com base nas informações do quadro e do gráfico de solubilidade versus temperatura, redijam no caderno as respostas para as questões a seguir. 23 Análise de dados 1. Em qual das substâncias o efeito da temperatura sobre a solubilidade é mais acentuado? 2. Em que temperatura a solubilidade do nitrato de chumbo é igual à do nitrato de prata? 3. Em que temperatura a solubilidade do cloreto de sódio é igual à do nitrato de potássio? 4. À temperatura de 20 0C, qual das substâncias relacionadas no quadro é mais solúvel em água? Qual é menos solúvel? 5. À temperatura de 60 0C, qual das substâncias relacionadas no quadro é mais solúvel em água? Qual é menos solúvel? 6. Se vocês resfriassem até 20 0C uma solução saturada de nitrato de chumbo que foi preparada a 80 0C, usando 100 g de água, qual a massa de nitrato de chumbo que ficará insolúvel e decantará no fundo do béquer? Para finalizar, leve para a aula a massa (g) de uma colher rasa de sal. Com o auxílio do quadro e do gráfico, peça que os alunos calculem o número de colheres rasas de sal, cuja massa é possível dissolver em 200 ml de água. Retome a tarefa deixada da aula anterior e questione: “a estimativa de vocês foi próxima do valor verdadeiro?” Nesse momento, os alunos possuem conteúdos suficientes para formalizar o conceito de solubilidade. Então, solicite que eles escrevam em seus cadernos com suas próprias palavras o conceito de solubilidade. Em seguida, defina formalmente o conceito de solubilidade: A solubilidade de um soluto qualquer, em gramas de soluto por litro de solução (g/L) para uma determinada temperatura. Esse valor expressa quantos gramas (g) do soluto é possível dissolver em um litro da solução até o seu limite de saturação. Peça que os alunos façam, se necessário, os reparos em suas definições. 24 Para finalizar o estudo sobre propriedades químicas, propõe-se uma lista de exercícios (valorize exercícios realmente problematizadores) para serem realizados nos Estudos Orientados, em momentos de Autogestão e em aula. Exercícios interessantes podem ser encontrados em: Química – projeto Voaz, páginas 54 e 55; v. 1; Química – na abordagem do cotidiano, páginas 38 a 40, v.1 e Química – ser protagonista, páginas 55-57, 66, 69-71, v. 1. Atividade 3: Separação de misturas Resumo: os alunos vão conhecer, realizando uma pesquisa, os principais métodos físicos de separação de misturas e suas principais aplicações, além de métodos eficientes para a separação de misturas simples em seus componentes. A atividade reforçará a autonomia dos alunos, iniciando a sua preparação como cidadãos que consigam gerir a informação para construir conhecimento e resolver problemas. Objetivo: possibilitar a resolução de problemas que relacionam as propriedades estudadas na unidade anterior, com técnicas simples, tendo em vista que os métodos de separação de misturas oferecem uma aplicação imediata das propriedades das substâncias para o isolamento dos componentes em uma mistura e que esse conteúdo é um tema bastante recorrente na sociedade, com bons exemplos no cotidiano e na indústria de base. Duração prevista: 2 tempos, mais pesquisa em tempos de Autogestão ou Estudos Orientados. Material: vídeos, livros de apoio, pesquisa Desenvolvimento Pesquisa – métodos de separação de misturas (1 tempo) Com vídeo ou slides de apoio, inicie contextualizando o problema. Podem ser apresentados exemplos de como os métodos de separação de misturas estão 25 presentes no nosso cotidiano e são importantes para obtermos materiais de larga aplicação pela sociedade. Bons exemplos estão no petróleo (material de grande relevância social no Brasil e no mundo, mas especialmente presente no cotidiano do Estado do Rio de Janeiro). A argumentação pode estar ligada à pequena utilidade do petróleo bruto, mas há grande aplicação dos seus derivados em nosso cotidiano, como os combustíveis e os reagentes da indústria petroquímica. O processo de destilação fracionada que ocorre na refinaria pode ser apresentado como ilustração, sem preocupação de esgotar o conceito. A preparação da bebida café é outro exemplo para explorar. Os alunos já perceberam que parte do pó de café não é solúvel em água quente? A discussão deve convergir para a importância das condições em que o café é preparado para se obter uma bebida agradável (o que depende do gosto de cada um), mas a temperatura da água e as quantidades de pó e água bem como a velocidade da extração são determinantes da composição da bebida. É importante que, durante a exposição, o professor estimule a participação dos alunos, que podem apresentar os seus conhecimentos do cotidiano ou do curso de Ciências de Ensino Fundamental. Além disso, a apresentação pode ser ilustrada com vídeos do processo de refino do petróleo (http://www.youtube.com/watch?v=7fh68hjKk4E), ou ainda da preparação do café. Para a pesquisa a ser proposta, a classe deve ser dividida em 5 equipes e cada uma pesquisar determinado método de separação de mistura, apresentando os seus resultados por meio de um painel (cartaz) a ser fixado na sala. Além disso, as equipes farão uma breve apresentação (5 minutos), ilustrando os resultados da pesquisa para os seus colegas. Cada equipe terá como objetivo propor um método de separação de uma das seguintes misturas: solução aquosa de sulfato de cobre (II); mistura de água e óleo; mistura de areia e sal; 26 mistura de limalha de ferro e areia; mistura de gasolina e álcool (gasolina utilizada no Brasil), caso em que o objetivo seria determinar o teor de álcool na gasolina. Cada pesquisa deve contemplar: o levantamento das propriedades físicas dos componentes de cada mistura (o mais completo possível); a descrição do método de separação adequado para a separação da mistura em um laboratório. Caso seja uma separação de mistura relevante para a indústria, apresentar também o método industrial. A descrição deve ilustrar cada aparelho empregado e seu respectivo funcionamento. Deve também mostrar por que esse método é eficiente para essa determinada mistura. O painel e apresentação devem conter figuras, esquemas ou vídeos ilustrativos do processo e dos aparelhos; a indicação das propriedades dos componentes que permitem que o procedimento de separação seja eficiente; as aplicações do método em processos relevantes para o cotidiano das pessoas ou para a produção industrial, com as semelhanças e as diferenças em relação ao procedimento realizado no laboratório. Duas semanas são uma estimativa razoável para a realização da pesquisa, sendo ideal que os alunos possam utilizar para a atividade um período de estudos em que ficam na escola e que o processo não seja realizado nas aulas de química da grade curricular. Para melhor organização do trabalho, é importante que cada equipe receba a orientação para a pesquisa por escrito. Seria interessante oferecer aos alunos um horário na semana para tirar dúvidas sobre o projeto (fora do horário de aula). Além dos livros didáticos disponíveis na biblioteca, a Internet, principalmente páginas ligadas às universidades, deve ser indicada como referência bibliográfica. Exemplos: http://www.infoescola.com/quimica/separacao-de-substancias-misturas/; http://www.cdcc.usp.br/exper/fundamental/roteiros/separa.pdf; http://educar.sc.usp.br/ciencias/quimica/qm1-2.htm 27 Se possível, promova a ida das equipes ao laboratório para que efetivamente procedam à separação da mistura de sua pesquisa. Para isso, será necessário um combinado na aula anterior quanto à mistura a ser apresentada e os materiais disponíveis para realizar o procedimento, o que permitirá aos alunos organizarem-se e prepararem o seu próprio roteiro. Ao final da aula, os alunos poderão circular pelo laboratório para conhecer a aparelhagem e o procedimento realizado pelos demais grupos. Nesse caso, será preciso organizar essa circulação, para evitar problemas de segurança, como aglomerações ou esbarrões que poderiam provocar acidentes. Avaliação da aprendizagem Antes de fechar a nota deste bimestre, procure responder às seguintes perguntas: As produções dos alunos, escritas ou orais, o auxiliaram na avaliação deles? Elas permitiram antever alunos que precisavam de algum tipo de acompanhamento especial ou recuperação de algum conhecimento anterior? Foi possível identificar os jovens que podem avançar e aqueles que precisam de recuperação no próximo bimestre? Tendo em mãos todos os dados de cada aluno, verifique se a nota final revela de fato o que ele aprendeu, ou seja, se há nessa nota sentido revelador do trabalho realizado pelo aluno e por você, professor, em relação a ele. Avaliação de sua gestão das aulas Analise seus registros e verifique em que sentido o ensino pode melhorar e os cuidados ou providências que dependem de você ou da escola para que o ensino de Química seja cada vez mais adequado aos alunos. Responda para você mesmo: Como foi o aproveitamento dos tempos das aulas? sua pontualidade? 28 O que precisa melhorar em seu planejamento das aulas? Os recursos para as atividades foram adequados? O que precisa ser providenciado? A cada início de aula você escreveu no quadro quais eram os objetivos da aula e disse o que se esperava dos alunos? Quais foram suas atitudes em aula que geraram boas aprendizagens dos alunos? 29
Download