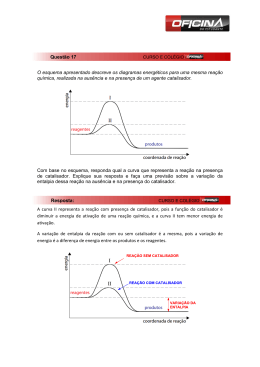
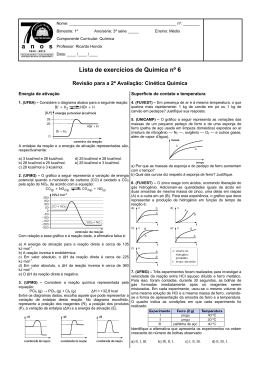
Química 1 – 2ºs anos – Ensino Médio Prof. Mauro Martins – El Maurón Lista de Exercícios de Revisão sobre Cinética Química 1) A decomposição do peróxido de hidrogênio pode ser representada pela equação: H2O2(l) → H2O(l) + 1/2O2(g) Das seguintes condições: I. 35º C e presença de catalisador. II. 35º C e ausência de luz. III. 25º C e presença de luz. IV. 25º C e presença de catalisador. V. 25º C e ausência de luz. Aquela que favorece a conservação do peróxido de hidrogênio é: m) I a) II u) III r) IV o) V 2) Você está cozinhando batatas e fazendo carne grelhada, tudo em fogo baixo, num fogão a gás. Se você passar as duas bocas do fogão para fogo alto, o que acontecerá com o tempo de cozimento? m) Diminuirá para a carne e permanecerá o mesmo para as batatas. a) Diminuirá para a carne e aumentará para as batatas. u) Diminuirá para os dois alimentos. r) Não será afetado. o) Diminuirá para as batatas e não será afetado para a carne. 3) (PUC-SP) Sobre o gráfico abaixo, é incorreto afirmar que: m) Na reação direta ∆H=-bc. a) A reação inversa é exotérmica. u) A energia de ativação da reação inversa é ca. r) O complexo ativado está em a. o) E e D são reagentes na reação inversa. 4) (CEFET-MG) O diagrama abaixo representa a variação de energia ocorrida na combustão do álcool etílico, de acordo com a equação: De acordo com o gráfico, pode-se afirmar corretamente que: m) A energia de ativação da combustão vale (a+b) kcal. a) A energia liberada na combustão é (b) kcal/mol de álcool. u) O complexo ativado tem conteúdo energético (a+b) kcal. r) O ∆H da reação de combustão é (ba) kcal/mol. o) O conteúdo energético dos reagentes é menor que o conteúdo energético dos produtos da combustão. 5) (UFMS/98) Com relação à cinética de uma dada reação química e sendo ∆H = variação da entalpia, é correto afirmar que: 01. As reações químicas serão mais rápidas quanto maior for o número de partículas reagentes com energia igual ou superior à energia de ativação. 02. Um catalisador aumenta a velocidade de uma reação química, porque diminui o valor de ∆H. 04. Todas as colisões intermoleculares resultam em reação química. 08. O aumento do número de colisões intermoleculares, devidamente orientadas, favorece a reação química. 16. Um catalisador aumenta a velocidade de uma reação química, pois diminui o valor da energia de ativação. 32. A pulverização de um reagente sólido influi na velocidade de suas reações. Química 1 – 2ºs anos – Ensino Médio Prof. Mauro Martins – El Maurón 6) (UFMS/02-Exatas) Um estudante de química observou a reação de decomposição abaixo, a 25ºC. H2CO3(aq) → H2O(l) + CO2(aq) Medindo a concentração, em mol/L, de CO2 , nos tempos 5 e 15 segundos, o estudante obteve, respectivamente, [ CO2 ] = 0,1 mol/L e [ CO2 ] = 1,1 mol/L. Determine a velocidade média dessa reação no intervalo de 5 a 15 segundos. Para efeito de resposta, multiplique o resultado por 20. 7) Ao se fazer pão caseiro, coloca-se a massa, em geral, coberta, “descansando” em lugar mais aquecido, a fim de que “cresça”. Esse fato pode ser interpretado da seguinte forma: m) Como uma prática caseira e que não está relacionada a fenômeno químico. a) Que o leve aumento de temperatura aumenta a velocidade de reação dos componentes da massa. u) Que o ambiente mais aquecido evita que a massa estrague. r) Que o leve aumento da temperatura diminui a fermentação da massa. o) Como um modo de evitar que a mistura se torne heterogênea polifásica. 8) (FEPAR) Fazem-se as afirmações abaixo. I. Todas as colisões moleculares entre quaisquer gases diferentes levam à reação química. II. A colisão molecular é efetiva se tiver orientação adequada e se estiver provida de um mínimo de energia. III. A energia mínima de que as moléculas necessitam para reagir por colisão chama-se energia de ativação, que pode ser baixada pelo uso de um catalisador. IV. Em processos que apresentam duas ou mais etapas, a velocidade de reação é determinada pela etapa mais rápida, por requerer maior energia de ativação. V. Energia de ativação de uma reação depende da natureza das substâncias reagentes. Assinale: m) Se somente a II, a III e a V estiverem corretas. a) Se somente a I estiver correta. u) Se somente a III e a IV estiverem corretas. r) Se somente a V estiver correta. o) Se somente a II, a III, a IV e a V estiverem corretas. 9) (UnB-DF- Adaptada) O biodigestor uma das soluções tecnológicas para o tratamento do lixo - consiste em um reservatório no qual são favorecidas as condições para a decomposição de matéria orgânica em seu interior por meio da ação de bactérias aeróbicas. O conhecimento a respeito de cinética química permite entender aspectos relativos aos processos que ocorrem nesse sistema. Com relação a esse assunto, julgue os itens que se seguem. 01. De acordo com a teoria das colisões, um aumento de temperatura no interior de um biodigestor tende a aumentar a velocidade das reações químicas. 02. A moagem do material a ser colocado no biodigestor provocará a redução da velocidade das reações químicas de decomposição, devido à diminuição do tamanho dos fragmentos a serem decompostos. 04. O trabalho de decomposição das bactérias poderá ser acelerado por meio do aumento da concentração de oxigênio no interior do biodigestor. 08. Segundo a teoria cinética, nem todas as colisões entre as moléculas dos gases no interior do biodigestor resultarão na formação de produtos.
Download