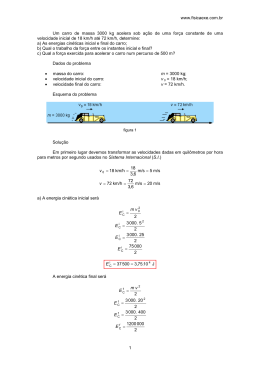
Cinética Química José Guerchon Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode Visualizações Cinética Química Cinética Química Objetivo Na física, a velocidade está associada a tempo e espaço. Na química, leva-se em conta o tempo e a concentração em quantidade de matéria. Isto pode ser facilmente percebido pelo aprendiz através de um experimento simples que possibilita visualizar a influência da concentração na velocidade e a ordem do reagente. O objetivo deste vídeo é mostrar como a velocidade de uma reação é influenciada pela concentração dos reagentes através de simples visualizações de cores que surgem a tempos diferentes. Informações Importantes 1) A cinética química estuda a velocidade das reações e os fatores externos que podem alterar essa velocidade, como a concentração dos reagentes, por exemplo. Quanto maior a concentração dos reagentes, maior é a probabilidade de colisões efetivas, menor é o tempo de reação e maior é a velocidade de reação. 2) A velocidade média de uma reação química pode ser definida como a variação da concentração de reagente na unidade de tempo. No experimento a velocidade para cada concentração inicial de iodato foi determinada como o inverso do tempo de aparecimento da cor azul. 3) Iodo em contato com a parte interna de uma batata gera composto de coloração azul devido ao amido contido na batata. Uma forma de identificar iodo em solução é adicionar a ela goma de amido que, na sua presença, adquire coloração azul. 4) Na reação de iodato em excesso com bissulfito contendo goma de amido forma-se iodeto. Devido ao iodato estar em excesso e, estando o meio acidificado, ele reage com o iodeto formado, gerando iodo molecular que na presença de amido forma composto de coloração azul. 5) A concentração de uma solução diluída (Cf) a partir de um volume conhecido (Vi) de uma solução concentrada (Ci) pode ser determinada assim: Ci x Vi = Cf x Vf, sendo Vf o volume da solução após diluição. . 1 . Visualizações Cinética Química Tabela 1 6) No experimento, constata-se que o iodato é um reagente de 1a ordem, pois ao dobrar a sua concentração dobra a velocidade de reação Dados do experimento: Tabela 2 A velocidade de reação do iodato é diretamente proporcional à sua concentração. Reações mostradas nos experimentos: Iodeto formado na reação acima reage com o excesso de iodato em meio ácido: O iodo molecular, produzido nessa reação, forma com o amido existente na solução um composto de forte coloração azul. Obs. Esse experimento é conhecido como “reação relógio”. . 2 . Visualizações Cinética Química Fotos Figura 1: Cálculos do experimento Figura 1: Cálculos do experimento . 3 . Visualizações Vídeo Figura 2: Vídeo das fases do experimento . 4 . Cinética Química
Download