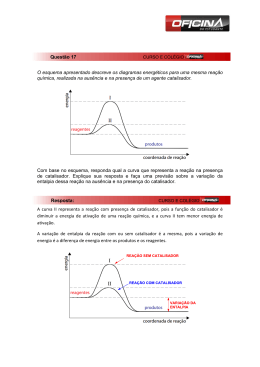
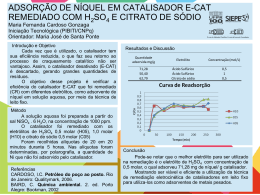
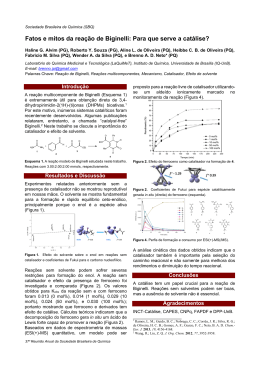
Anais do IX Seminário de Iniciação Científica, VI Jornada de Pesquisa e Pós-Graduação e Semana Nacional de Ciência e Tecnologia UNIVERSIDADE ESTADUAL DE GOIÁS 19 a 21 de outubro de 2011 SÍNTESE E AVALIAÇÃO DA ATIVIDADE CATALÍTICA E CITOTÓXICA DE DERIVADOS DE CHALCONAS Giulio Demetrius Creazzo d’Oliveira (UEG)*; Caridad Noda Pérez (UFG) [email protected]; [email protected] Introdução Houve nas ultimas décadas um enorme avanço na tecnologia de desenvolvimento de fármacos, o que se deve em parte à insubstituível função que os produtos naturais têm tido na terapêutica. Fornecendo sempre novas moléculas para ensaios de bioatividade contra um vasto número de doenças ainda incuráveis, sua importância fica evidente na estimativa de que 40 % dos medicamentos disponíveis na terapia atual foram desenvolvidos de fontes naturais (CARLIXTO, 2003). Ao passo que a química teórica, no âmbito do desenvolvimento de novos fármacos tenta vencer na exatidão dos seus resultados, a química dos produtos naturais tenta vencer fornecendo um arsenal imensurável de moléculas diferentes, um verdadeiro banco de moléculas. Um exemplo dessa busca quantitativa de novas moléculas é o trabalho desenvolvido pelo NCI (National Cancer Institute – EUA), que testa a citotoxicidade de cerca de 10.000 moléculas a cada ano contra células carcinômicas. A química orgânica sintética também desempenha um importante papel visto que à partir do momento que uma nova molécula natural é descoberta eficaz para o tratamento de uma determinada chaga há uma corrida para se determinar uma forma sintética de se produzir tal molécula, já que os produtos naturais são geralmente escassos nas fontes que os contêm e o isolamento em massa dos mesmos pode ser extremamente caro, impossibilitando que determinado fármaco seja acessível para a maioria da população se tratar. Uma classe de compostos que têm sido extensamente estudada pelo fato de reportarem na literatura diversas atividades biológicas diferentes são os flavonóides e as chalconas, tendo exemplares apresentando atividades como, por exemplo, diminuição da permeabilidade capilar sanguínea e o aumento de sua resistência, como antiinflamatórios, antialérgicos, hepatoprotetores, antiespasmódicos, propriedades antioxidantes (devida as suas excelentes propriedades de quelação com o ferro) e captadores de radicais livres, ação anti-proliferativa e anticancerígena (FLÓREZ,2002, CUNHA, et al, 2006), atividade colerética, atividade antiulcerosa e mucoprotetora (SANTOS, 2008). PALAVRAS CHAVES: Chalconas, catálise, atividade citotóxica, síntese. Objetivo O presente trabalho teve como objetivo o estudo do efeito da temperatura e a concentração do catalisador nas reações de síntese das chalconas (E)-3-(4-aminofenil)-1-(4-nitrofenil)prop-2-en1-ona (3a), (E)-3-(4-aminofenil)-1-(4-hidroxifenil)prop-2-en-1-ona (3b), (E)-1-(4-nitrofenil)-3fenilprop-2-en-1-ona (3c) e (E)-1-(4-hidroxifenil)-3-fenilprop-2-en-1-ona (3d), via condensação reação condensação de Claisen-Schmidt à partir das cetonas e aldeídos aromáticos (acetofenona, 4aminoacetofenona, 4-hidroxibenzaldeído e 4-nitrobenzaldeído) sob diferentes condições catalíticas, com o posterior isolamento para identificação estrutural e ensaios biológicos de citotoxicidade em de células tumorais humanas e a avaliação do IC50. 1 Anais do IX Seminário de Iniciação Científica, VI Jornada de Pesquisa e Pós-Graduação e Semana Nacional de Ciência e Tecnologia UNIVERSIDADE ESTADUAL DE GOIÁS 19 a 21 de outubro de 2011 *PBIC/UEG Metodologia - Reações: Nas reações foram usados como reagentes 4-aminoacetofenona, acetofenona, 4hodroxibenzaldeído e 4-nitrobenzaldeído com pureza grau reagente. O hidróxido de potássio usado como catalisador tinha pureza analítica. Os solventes empregados nos testes reacionais e na extração foram o metanol e o diclorometano com pureza para síntese. O aparato experimental consistiu em um reator (balão de vidro com boca esmerilhada de fundo redondo de 50 mL) acoplado a um condensador para refluxo, uma chapa aquecedora provida de agitador magnético e a barra magnética. Os reagentes (cetona e aldeído) foram pesados ou pipetados e colocados a seguir no balão reator. Adicionou-se a solução de catalisador em volume que contivesse a massa equivalente a 2%, 5% e 10% em peso em função do peso da acetofenona ou da 4-aminoacetofenona. Essa solução foi preparada com metanol e hidróxido de potássio de tal forma que cada mL contivesse quantidade de catalisador equivalente em massa a 1% da massa da acetofenona ou da 4-aminoacetofenona. A seguir adicionava-se metanol para que o volume final fosse de 15 mL. Montava-se o sistema de refluxo com a solução da reação sob agitação magnética e o balão submerso em banho-maria sob a temperatura proposta. Quando ocorria a formação de precipitado a solução era filtrada. Quando não ocorria a formação do precipitado o produto da reação era submetido à lavagem com água destilada, seguida de extração com diclorometano. A fase orgânica era reservada e a fase aquosa era submetida a mais duas extrações com o diclorometano. As fases orgânicas se juntavam se lavavam mais uma vez com água. A fase orgânica era deixada em um béquer tampado até a evaporação total do solvente. A massa obtida então era pesada. - Citotoxicidade em linhagens de Células Tumorais: As análises da citotoxicidade foram realizadas no Laboratório de Oncologia Experimental da Universidade Federal do Ceará, sob responsabilidade da doutoranda Kristiana Cerqueira Mousinho, através do método de MTT, o qual vem sendo utilizado no programa de screening do National Cancer Institute dos Estados Unidos (NCI), que testa mais de 10.000 amostras a cada ano (SKEHAN et al.,1990). É um método rápido, sensível e barato. O estudo citotóxico pelo método do MTT permite definir facilmente a citotoxicidade, mas não o mecanismo de ação . Foi descrito primeiramente por Mosman em 1983, tendo a capacidade de analisar a viabilidade e o estado metabólico da célula. É uma análise colorimétrica baseada na conversão do sal 3-(4,5-dimetil-2-tiazol)-2,5-difenil-brometo de tetrazolium (MTT) em azul de formazan, a partir de enzimas mitocondriais presentes somente nas células metabolicamente ativas. Ou seja, a solução amarela de MTT é reduzida pela atividade mitocondrial nas células metabolicamente ativas em um cristal roxo (MUKHERJEE, Shubhasish, et al). As linhagens utilizadas, MDA-MB-435 (melanoma), HCT-8 (cólon humano), SF-295 (sistema nervoso central) e HL-60 (leucemia), foram cedidas pelo Instituto Nacional do Câncer (USA), tendo sido cultivadas em frascos plásticos para cultura, utilizando o meio RPMI 1640 suplementado com 10% de soro fetal bovino e 1% de antibióticos (penicilina/estreptomicina). As células foram incubadas em estufa a 37°C com atmosfera de 5% de CO2 e 95% de umidade, seguido da observação do crescimento celular com ajuda do microscópio de inversão a cada 24 horas, quando necessário as células foram repicadas em meio de cultura novo, em uma concentração de 0,1 x 106 céls/100µL. As substâncias foram diluídas em DMSO puro e estéril na concentração de 5µg/mL (dose única) e adicionadas em placas de 96 poços (100µL/poço). O quimioterápico doxorrubicina foi 2 Anais do IX Seminário de Iniciação Científica, VI Jornada de Pesquisa e Pós-Graduação e Semana Nacional de Ciência e Tecnologia UNIVERSIDADE ESTADUAL DE GOIÁS 19 a 21 de outubro de 2011 usado como controle positivo. Após um período de incubação de 72 horas, as placas foram retiradas e centrifugadas a 1500rpm/15 minutos. O sobrenadante foi aspirado e foi adicionado 200µL da solução de MTT 10% em RPMI 1640, sendo a placa colocada em estufa a 5% de CO2 por 3 horas. Em seguida, as placas foram novamente centrifugadas a 3000rpm/10 minutos, tendo o sobrenadante aspirado e o precipitado ressuspendido em 150µL de DMSO e agitado por cerca de 10 minutos até completa dissolução dos cristais de formazan. A absorbância foi lida em um espectrofotômetro de placas a um comprimento de onda de 550nm. A determinação da concentração capaz de inibir 50% do crescimento celular (IC 50) das amostras selecionadas no screening inicial foi realizada pelo método do MTT em concentrações que variam de 0,078-5µg/mL. As células foram plaqueadas em placas de 96 poços nas seguintes concentrações (células/mL): - MDA-MB-435, SF-295: 0,1 x 106; - HCT-8: 0,7 x 105; - HL-60: 0,3 x 106; Os resultados foram analisados segundo suas médias e respectivos desvios-padrão no programa GraphPad Prism. Cada amostra foi analisada a partir de dois experimentos realizados em duplicata. Resultados e Discussão - Reações: O produto das reações entre 4-amino-acetofenona com 4-hidroxi-benzaldeído e 4-nitrobenzaldeído não precipitou na reação e foi necessário fazer a quantificação por CG após extração com diclorometano. O produto das reações entre acetofenona e 4-nitro-benzaldeído precipitava puro e sua quantificação foi feita diretamente a partir da pesagem do precipitado. Os resultados da reação (a) (4-aminoacetofenona e 4-hidroxibenzaldeído) mostram que o aumento da massa de catalisador não favoreceu a reação, pois foi observada a diminuição do rendimento ao produto da reação. Já para as reações efetuadas com 4-nitrobenzaldeído o efeito do catalisador foi menos significativo, pois os resultados levaram a rendimentos similares para as três concentrações testadas. A única diferença entre as reações anteriormente analisadas foi o aldeído usado (4hidroxibenzaldído ou 4-nitrobenzaldeído). Para este tipo de reações, quanto mais eletrófilo o aldeído seja, mais favorecida será a reação. A retirada do próton da hidroxila fenólica do 4hidroxibenzaldeído é desvantajosa, já que a carga resultante é espalhada pela molécula aumentando a densidade eletrônica na carbonila e consequentemente diminuindo o seu caráter eletrofílico. Por isso a reação com 4-hodroxibenzaldeído é mais sensível à variação da concentração do catalisador do que a reação que faz uso de 4-nitrobenzaldeído como aldeído. Os resultados obtidos na reação entre acetofenona e 4-nitrobenzaldeído, mostram um aumento do rendimento com a concentração de catalisador. Quase não foi observada a formação do produto desta reação quando foi usado 2% de catalisador. Já o aumento de 5 para 10% em peso do catalisador quase duplicou o rendimento ao produto da reação. Para essa reação, outra variável avaliada foi o do tempo de reação. Para a reação efetuada com 5% em peso de catalisador, um aumento do tempo de reação de 4 horas para 72 horas levou a um aumento significativo do rendimento da mesma. Mas quando esta reação foi feita com o mesmo tempo de reação, mas com 10% em peso de catalisador, o aumento no rendimento não foi significativo quando comparado com o resultado da reação usando 5% em peso de catalisador. Assim então, pode-se considerar que esta reação é mais afetada pelo tempo de reação do que pelo teor de catalisador. Comparando esta reação com a reação entre 4-aminoacetofenona e 4-nitrobenzaldeído, observa-se que agora a diferença está na cetona usada. A presença de um grupo amino na posição para mudou o comportamento em função da massa de catalisador. Para a reação com acetofenona foi observado um aumento do rendimento com o teor de catalisador, mas na maior concentração 3 Anais do IX Seminário de Iniciação Científica, VI Jornada de Pesquisa e Pós-Graduação e Semana Nacional de Ciência e Tecnologia UNIVERSIDADE ESTADUAL DE GOIÁS 19 a 21 de outubro de 2011 (10%) os rendimentos de ambas as reações são similares. Assim não se pode afirmar que a presença do grupo amino aumentou a nucleofilicidade da molécula, mas sim que diminui o pKa relativo ao hidrogênio do carbono da carbonila cetônica, o que pode ser devido a facilidade de protonação sob baixas concentrações de catalisador. Na reação entre acetofenona e p-hidroxibenzaldeído não foi observada a formação do produto esperado. Este resultado pode ser devido à que o 4-hidroxi é um grupo fortemente desativante e a reação com a acetofenona é mais difícil do que com a 4-aminoacetofenona. Outra questão que foi levantada quando se avaliava o porquê dos resultados foi que a tendência observada poderia ser, na verdade, conseqüências do efeito do catalisador na etapa de extração, sendo que maior quantidade de OH- para as reações poderiam afetar o coeficiente de partição do produto, arrastando-o para a fase aquosa durante a extração com diclorometano. Daí o rendimento das reações catalisadas com 10% terem sido menores que as catalisadas com 2% poderiam ser porque simplesmente na etapa da extração o produto permanecia na fase aquosa. O ideal seria que todas as reações fossem neutralizadas antes de se operar as extrações. - Citotoxicidade em linhagens de Células Tumorais: A chalcona (E)-1-(4-nitrofenil)-3-feniolprop-2-en-1-ona (CG I) foi testada na concentração única de 5µg/mL, através do método de MTT nas linhagens MDA-MB-435 (melanoma), HCT-8 (cólon) e SF-295 (sistema nervoso central). Valores de potencial de inibição do crescimento tumoral maiores que 90% são considerados relevantes. A amostra CGI apresentou potencial citotóxico relevante e foi encaminhada para a determinação da IC50. Este composto apresentou pronunciada ação na linhagem HCT-8. O teste de IC50 foi realizado pelo método de MTT em concentrações que variam de 0,0785µg/mL. Foram utilizadas quatro linhagens de células tumorais: HL-60 (leucemia), MDA-MB-435 (melanoma), HCT-8 (cólon) e SF-295 (sistema nervoso central). Substâncias que apresentaram IC50 menor que 4µg/mL são consideradas potencialmente ativas. A amostra CGI apresentou elevado potencial citotóxico, com IC50 menor que 1µg/mL, não apresentando seletividade entre as linhagens. Considerações Finais No presente trabalho foi estudada a síntese derivados de chalconas usando como cetonas a 4-aminoacetofenona e a acetofenona e como aldeídos o 4-hidroxibenzaldeído e o 4nitrobenzaldeído, em solução de hidróxido de potássio como catalisador. Durante o estudo foi avaliado o efeito do teor de catalisador e do tempo de reação no rendimento aos produtos das reações. Os compostos, (E)-3-(4-aminofenil)-1-(4-nitrofenil)prop-2-en-1-ona (3a), (E)-3-(4aminofenil)-1-(4-hidroxifenil)prop-2-en-1-ona (3b), e (E)-1-(4-nitrofenil)-3-fenilprop-2-en-1-ona (3c) foram obtidos com rendimentos na faixa de 50%. Já o produto da reação entre aminoacetofenona e 4-hidroxibenzaldeído, (E)-1-(4-hidroxifenil)-3-fenilprop-2-en-1-ona (3d), não foi obtido. O aumento do teor de catalisador levou a um menor rendimento do produto 3a, entanto que para o produto 3b o seu efeito não foi significativo. O produto 3c precipitava facilmente no meio de reação. O aumento do tempo de reação de 4 para 72 horas levou a um aumento do rendimento. Já o aumento do teor de catalisador de 5 para 10 % com 71 horas de reação não mostrou um aumento significativo no rendimento da reação. O composto 3c, obtido puro, teve sua atividade biológica avaliada frente a três linhagens de células tumorais humano, HCT-8 (cólonhumano), MDA-MB (melanoma-humano) e SF-295 (gliobastoma-humano), apresentando uma potente atividade citotóxica contra o HTC-8. O IC50 foi avaliado empregando mais uma linhagem tumoral humana, HL-60 (leucemia), apresentando em todos os casos um valor de IC50 menor de 1 mg/mL. Sua estrutura foi caracterizada por RMN H1 e C13. 4 Anais do IX Seminário de Iniciação Científica, VI Jornada de Pesquisa e Pós-Graduação e Semana Nacional de Ciência e Tecnologia UNIVERSIDADE ESTADUAL DE GOIÁS 19 a 21 de outubro de 2011 Referências Bibliográficas ALLINGER, Norman L., et al, Química Orgânica, editora Guanabara Koogan S.A., Rio de JaneiroRJ, 1978, p.453-457. FLÓREZ, S. Martínez, et al, “Los Flavonóides: propriedades y acciones antioxidantes”, Departamento de Fisiologia, Universidad de León y hospital de Bon. España, Nutrición Hospitalaria, 2002. CUNHA, A. Proença, et al, “Plantas e produtos vegetais em Fitoterapia”, 2ª Ed., Edição da: Fundação Caluste Gulbenkean, Av. de Bernal, Lisboa, 2006, p. 45-46. MUKHERJEE, Shubhasish, et al, “Synthetic and biological evaluation studies on novel 1,3diarilpropenones”, Bioorganic & Medicinal Chemistry, v. 9, n. 2, p. 337-345, 2001.SANTOS, L. dos, 2008, Síntese, Caracterização e Avaliação do Potencial Biológico de Derivados Obtidos a Partir de Chalconas, Tese de D.Sc., UFSC, Florianópolis, SC, Brasil. INCA, site do Intituto Nacional do Câncer: www.inca.gov.br SKEHAN, H., et al, New colorimetric cytotoxicity assy for anticancer – drug screening. J. Natl. Câncer Insti., v. 82, n. 13, p. 1107-1112, 1990. 5
Download