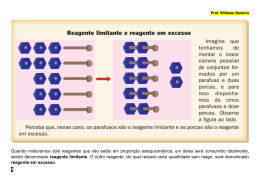
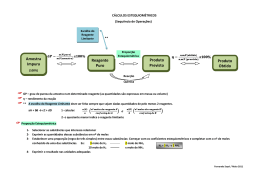
● Nem sempre uma reação ocorre por completo. ● Por exemplo, quando um dos reagentes está em excesso e parte dele não reage. ● O outro reagente, que é consumido primeiro, é denominado reagente limitante. Uma massa de 138 g álcool etílico (C2H6O) foi posta para queimar com 320g de oxigênio (O2), em condições normais de temperatura e pressão. Qual é a massa de gás carbônico liberado e o excesso de reagente, se houver? A reação balanceada é dada por: C2H6O(V) + 3 O2(g) → 2CO2(g) + 3H2O(v) 46 g 138g 96g 320g 88g Calculando a massa de gás carbônico: 46g de C2H6O ------------- 88g de CO2 138g de C2H6O ----------- x x = 264 g de CO2 A massa de oxigênio em excesso: 46g de C2H6O ------------- 96 O2 138g de C2H6O ----------- x x = 288 g de O2 A massa em excesso é a diferença da massa que foi colocada para reagir e a que efetivamente reagiu: 320g - 288g= 32 g O rendimento da reação é uma porcentagem do teoricamente esperado. Para tal, precisamos seguir os três passos listados abaixo: 1 – Calcular o rendimento teórico; Para tal, precisamos seguir os três passos listados abaixo: 1 – Calcular o rendimento teórico; 2 – Verificar se há reagente em excesso e reagente limitante; Para tal, precisamos seguir os três passos listados abaixo: 1 – Calcular o rendimento teórico; 2 – Verificar se há reagente em excesso e reagente limitante; 3 – Relacionar o rendimento teórico com o rendimento porcentual. Rendimento das Reações Químicas KOH+ H2SO4 → K2SO4 + 2H2O 56 – 98 112 – 197 Rendimento mensal das vendas 1) Misturam-se 147g de ácido sulfúrico e 100g de hidróxido de sódio para que reajam segundo a reação: NaOH + H2SO4→ Na2SO4 + 2H2O Dados: MM NaOH = 40 g/mol MM H2SO4 = 98 g/mol MM Na2SO4 = 142 g/mol Calcule: a) A massa do sulfato de sódio formado. b) A massa do reagente que sobra em excesso após a reação. 2) Descreva as etapas para se obter um rendimento das reações químicas.
Download