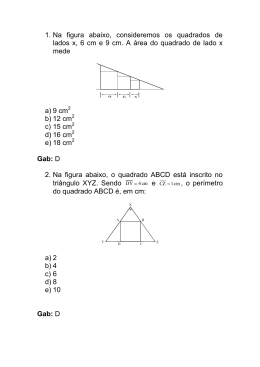
Professor: LISTA A DE RECUPERAÇÃO XUXU IV Bimestre SÉRIE: 3º ANO DATA: DA 05 / 10 / 2015 QUÍMICA Matéria Abordada: Equilíbrio Químico, Deslo ocamento de Equilíbrio Químico, Equilíbrio Iônico, Hidrólise Salin na, pH e pOH. 01 - (FUVEST SP) A uma determinada temperatura, as substânccias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o eequilíbrio entre as três substâncias foi estudado, em recipientes fechados, partindo-se de uma mistura equimolar de H2 e I2 (experimento A) ou somente de HI (experimento B). d) no ponto de equilíbrio não há u produto. concentrações do reagente ou alterações das 03 - (UECE) Os estudos pioneiros sobre equilíb brio químico efetivados por Claude Berthollet (1748-1822) forneceram subsídios para a otimização de certos processos de interesse da indústria química tais como a esterificação, a síntese do amoníaco, etc. uilíbrio químico assinale a Sobre reações reversíveis e equ afirmação verdadeira. a) b) c) d) No equilíbrio químico, as core es dos reagentes e produtos podem ser alteradas. No momento do equilíbrio as reações direta e inversa deixam de acontecer. Ao contrário do inibidor, o caatalisador aumenta apenas a velocidade da reação direta. No equilíbrio as concentraçõe es de reagentes e produtos se mantêm constantes. 04 - (UESC BA) Pela análise dos dois gráficos, pode-se concluir qu ue a) b) c) d) e) pressão total no no experimento A, ocorre diminuição da p interior do recipiente, até que o equilíbrio sseja atingido. no experimento B, as concentrações das ssubstâncias (HI, H2 e I2) são iguais no instante t1. ormação de HI no experimento A, a velocidade de fo aumenta com o tempo. no experimento B, a quantidade de matériia (em mols) de HI aumenta até que o equilíbrio seja atingid do. no experimento A, o valor da constante dee equilíbrio (K1) é maior do que 1. 02 - (UNIRG TO) A figura a seguir descreve uma reação hipotéticca em equilíbrio químico. Sobre este processo reacional pode-se aafirmar que O gráfico representa a variação da concentração de reagente e de produtos, durante a reação química representada pela equação química 2NO 2 (g) c afirmar: A partir da análise desse gráfico, é correto 01. 02. 03. 05. b) c) o composto A no ponto de equilíbrio foi totalmente consumido. o composto B no ponto de equilíbrio foi totalmente consumido. o composto B forma-se a partir do ponto dee equilíbrio 2NO O(g) + O 2 (g) , que ocorre no interior de um recipiente fechado, onde foi colocado inicialmente NO2(g), e após ter sido atingido o equilíbrio químico. 04. a) → ← –2 –1 A concentração inicial de NO é 4,0×10 mol.L . –1 A constante de equilíbrio, Keq q, é igual a 2,0mol.L . O equilíbrio químico é inicialm mente estabelecido no tempo X, representado no gráfico. A concentração de NO2(g),, no estado de equilíbrio químico, é a metade da conce entração de NO(g). A constante de equilíbrio, Keq, possui valores iguais quando o sistema atinge o tempo representado por Z e por Y, no diagrama. 05 - (Fac. de Ciências da Saúde de Barretos SP) Uma das etapas de obtenção do enxofre pelo processo conhecido como “processo Claus” envolve o equilíbrio químico representado pela equação: 2 H2S (g) + SO2 (g) 3 S (l) + 2H2O (l) A expressão da constante Kc desse equilíbrio e é dada por e) a) b) c) d) e) 3 [H2O]⋅[S] [H 2 O] ⋅ [S] 3 [H 2 S] 2 ⋅ [SO 2 ] 09 - (UECE) O óxido nítrico é um gás incolor que pode resultar de uma reação no interior de máquinas de combustão interna e, ao ser resfriado no ar, é convertido a dióxido de nitrogênio, um gás de cor castanha, que irrita os pulmões e diminui a resistência às infecções respiratórias, conforme a reação: 1 [H 2 S] 2 ⋅ [SO 2 ] 2 2 [H2S] ⋅[H2O] 1 [H 2 O] ⋅ [S] 3 2 NO(g) + O2(g) 06 - (UDESC SC) Para a reação em equilíbrio N2(g) + 3 H2(g) → ← 2 NH3(g) ∆H = Aumentar a concentração de H2 Aumentar a pressão Aumentar a concentração de N2 Aumentar a temperatura Diminuir a concentração de NH3 a) b) c) d) 07 - (FPS PE) A reação de obtenção do metanol a partir de monóxido de carbono gasoso e gás hidrogênio, descrita a seguir, apresenta 0 uma variação de entalpia padrão de reação (∆rH ) igual a –635,5 –1 kJ mol . CO(g) + 2H2(g) → → b) c) d) e) CH3OH(g) ∆H>0 Esta equação representa a reação química na qual se baseiam alguns objetos decorativos que indicam alteração no tempo, principalmente com relação a mudanças na umidade relativa do ar. A superfície do objeto é revestida com sais a base de cloreto de cobalto (II), que apresenta coloração azul. a) b) c) d) e) b) c) d) 2NH 3 (g ) ∆H = -26,2 Kcal A diminuição da temperatura, juntamente com aumento da umidade, desloca o equilíbrio para a direita, tornando azul a superfície do objeto. O aumento da umidade faz com que a concentração dos íons cloreto diminua, deslocando assim o equilíbrio para a direita. O aumento da umidade do ar faz com que o equilíbrio se desloque para a esquerda, tornando rosa a cor do objeto. A diminuição da temperatura, mantendo a umidade constante, torna o objeto azul. Aumentando a temperatura do sistema, a quantidade de NH3 aumentará. Retirando N2 do sistema, a quantidade de H2 irá diminuir. Mantendo a pressão do sistema constante, a quantidade de NH3 aumentará. Alterando a temperatura do sistema, a constante de equilíbrio para a reação não alterará. Refrigerando o sistema, a produção de amônia aumentará. 11 - (UNISA) Rochas calcárias, comercialmente classificadas como mármores, apresentam além do carbonato de cálcio outros compostos químicos que lhes conferem uma ampla variedade de cores e texturas. Quando uma estátua de mármore é submetida a uma atmosfera úmida e saturada de ácido sulfúrico, em um espaço confinado, a seguinte reação de equilíbrio se estabelece: CaCO 3 (s) + H 2 SO 4 (aq) ← → CaSO 4 (s) + CO 2 (g ) + H 2 O(l) Para que o equilíbrio se desloque para direita, é necessária a Com relação a esse equilíbrio, assinale a alternativa correta. a) ← → Considerando que a reação esteja em equilíbrio, é correto afirmar: 08 - (UDESC SC) Considere a seguinte reação química em equilíbrio: Na2CoCl4 + 6H2O azul adicionar um catalisador. aumentar a pressão. elevar a temperatura. retirar oxigênio. N 2 (g ) + 3H 2 (g ) Aumentando a temperatura, a pressão e mantendo o volume constante. Reduzindo o volume do recipiente, à temperatura constante. Diminuindo a pressão, à temperatura constante. Removendo CO(g). Adicionando CH3OH(g). Co(H2O)6Cl2 + 2NaCl rosa 2 NO2(g) ∆H <0 10 - (IFGO) A amônia pode ser obtida através do processo Haber, o qual pode ser representado de maneira simplificada através da equação química abaixo: Como o sistema em equilíbrio, mostrado acima, pode ser deslocado para formação do produto? a) ← → Considerando o sistema acima em equilíbrio, é correto afirmarse que a produção de dióxido de nitrogênio será favorecida quando se –22 kcal; assinale a alternativa que não poderia ser tomada para aumentar o rendimento do produto. a) b) c) d) e) O aumento da temperatura, mantendo a umidade constante, faz com que haja evaporação da água da superfície do objeto, tornando-o rosa. a) b) c) d) e) remoção de gás carbônico. remoção de ácido sulfúrico. adição de sulfato de cálcio. adição de água. adição de um catalisador. 12 - (FGV SP) A produção de suínos gera uma quantidade muito grande e controlada de dejetos, que vem sendo empregada em bioconversores para geração de gás metano. O metano, por sua vez, pode ser utilizado para obtenção de gás H2. Em uma reação denominada reforma, o metano reage com vapor-d’água na 2 presença de um catalisador formando hidrogênio e dióxido de carbono de acordo com o equilíbrio Ácido pKa 3H2 (g) + CO2 (g) ∆Hº > 0. CH4 (g) + H2O (g) O deslocamento do equilíbrio no sentido da forrmação do H2 é favorecido por: I. II. III. aumento da pressão; adição do catalisador; aumento da temperatura. a) b) c) d) e) I. I e II. II. II e III. III. 13 - (UNESP SP) dam compostos Para a produção de energia, os mamíferos oxid de carbono nos tecidos, produzindo dióxido de ccarbono gasoso, CO2 (g), como principal subproduto. O principal meio de remoção do CO2 (g) gerado nos tecidos envolve sua dissolução m a água, sob a em água, seguida da reação do gás dissolvido com ação de um catalisador biológico, a enzima aniddrase carbônica, como representado a seguir. CO2 (g) CO2 (aq) + H2O(l) b) c) d) e) IV V 3,2 3 0,5 0 I II III IV V 15 - (Univag MT) Amplamente usado no tratamento da anemia, o sulfato ferroso b fraca e um ácido forte. (FeSO4) é um sal originário de uma base Dissolvendo uma amostra desse e sal na água, conclui-se corretamente que essa solução tem m a) b) c) d) e) caráter básico, logo pH < 7. + – caráter ácido, logo [H ] < [OH ]. caráter neutro, logo pH = 7. + – caráter ácido, logo [H ] > [OH ]. caráter básico, logo pH > 7. CO2 (aq) + calor (etapa 11) HCO 3− (aq) + H (aq) (etapa 2) + A respeito desse processo, é correto afirmar que a) 9,2 9 8,6 8 4 4,8 Analisando-se os dados de pKaa, conclui-se que a maior luminosidade foi observada quando o os fios foram colocados na solução do ácido É correto apenas o que se afirma em a) b) c) d) e) I II III a reação de formação de HCO 3− (aq) na etaapa 2 só ocorre na presença do catalisador biológico. a concentração de CO2 (aq) não influi na aciidez do meio. + a concentração de H (aq) aumenta com a elevação da temperatura. + a concentração de H (aq) não varia com m a elevação da temperatura. o aumento da concentração de CO2 (aq) au umenta a acidez do meio. 14 - (UFG GO) do para testar a Observe o sistema esquematizado abaixo, utilizad condutividade elétrica de várias soluções ácidas. Nesse sistema, as soluções funcionam como chave do circuito eléétrico. 16 - (UNESP SP) Em um estudo sobre extração de enzimas vegetais para uma indústria de alimentos, o professorr solicitou que um estudante escolhesse, entre cinco soluçõe es salinas disponíveis no laboratório, aquela que apresentassse o mais baixo valor de pH. Sabendo que todas as soluções dissponíveis no laboratório são aquosas e equimolares, o estudante e deve escolher a solução de a) b) c) d) e) (NH4)2C2O4. K3PO4. Na2CO3. KNO3. (NH4)2SO4. 17 - (UFU MG) p de larga aplicação O bicarbonato de sódio é um produto doméstica: na culinária, para diminu uir a acidez de molhos; como medicamento, no combate à azia e para neutralizar a acidez bucal; em desodorantes, para neuttralizar a ação de ácidos que causam o cheiro de suor, entre outrras aplicações Essa variedade de aplicações é devid da à a) b) c) Sabe-se que, no caso dos ácidos, quanto maaior o grau de ionização, maior a intensidade da luz emitida peela lâmpada. Ao se realizar o teste de condutividade com as cin nco soluções de mesma concentração, preparadas com ácidos (II, II, III, IV e V), observaram-se diferentes intensidades luminosas, ao se mergulhar os fios nas soluções. Considere os seeguintes valores de pKa para os ácidos. d) decomposição do ácido carbô ônico gerado, formando água e gás carbônico. elevada força básica do sal, que reage com ácidos para neutralizá-los. hidrólise do ânion em água, fo ormando soluções levemente básicas. formação do ácido carbônico em água, que diminui o pH da solução. 18 - (UPE PE) entava pH igual a 6,0, foram Em um aquário onde a água aprese colocados peixes ornamentais procedentes de um rio cuja água tinha pH um pouco acima de 7,0. Em razão disso, foi necessário realizar uma correção do pH dessa água. Entre as substâncias a 3 seguir, qual é a mais indicada para tornar o pH da água desse aquário mais próximo do existente em seu ambieente natural? a) b) c) d) e) 23 - (IBMEC RJ) De acordo com a tabela abaixo, a te emperatura de 25 graus: KBr NaCl NH4Cl Na2CO3 Al2(SO4)3 19 - (FMJ SP) Em uma aula de laboratório, utilizando-se água destilada (pH = 7,0), foram preparadas separadamente soluções 0,1 mol/L de I. II. III. IV. cloreto de potássio; nitrato de amônio; acetato de sódio; nitrato de alumínio. Indique as substâncias que possuem m caráter ácido: a) b) c) d) e) or universal. O pH das soluções foi medido com papel indicado Apresentaram valores de pH menor que 7 apenass as soluções a) b) c) d) e) I e III. I e IV. II e III. II e IV. III e IV. 24 - (PUC RS) Analise a tabela incompleta a seguirr, sobre valores típicos de pH + – e de concentração de íons H e OH em alguns líquidos. 20 - (FPS PE) O líquido secretado e lançado no estômago é d denominado de suco gástrico. O suco gástrico constituído d de água, ácido clorídrico, muco, enzimas e sais, é uma mistura de secreções das células epiteliais superficiais e das secreções das glândulas gástricas. O pH no interior do estômaggo é devido, principalmente, ao ácido clorídrico, um ácid do forte, cuja –14 ionização é total em meio aquoso. Considerando o que Kw = 10 –1 e que uma solução aquosa 0,01 mol L de áciido clorídrico é ideal, em 25 ºC, o seu pOH será igual a: a) b) c) d) e) Logo, é correto afirmar, exceto: a) b) c) d) Pela análise da tabela, é correto afirrmar que a) 2 4 7 10 12 21 - (ACAFE SC) + –7 Uma determinada solução aquosa apresenta [H ] = 3×10 mol/L sob temperatura de 60ºC. –14 Dado: Considere Kw = 9×10 sob temperatura de 60ºC. log3 = 0,48. A solução aquosa apresenta pH = 6,52. A solução aquosa apresenta pOH = 7,48. –6,52 A solução aquosa apresenta [OH-] = 10 mol/L. Nas condições abordadas é válida a seguintte relação: pH + pOH < 14. b) c) d) e) a água da chuva é mais ácidaa do que a água do mar, e o leite é menos ácido do que o café. c dentre os líquidos apresentad dos, o mais ácido é a água da chuva e o mais alcalino é o leitte. o café tem pH 5, sendo menos ácido do que o sangue humano. o leite é mais ácido do que a água da chuva, e o café é mais ácido do que o suco de maçã. m a soma dos pHs da água da chuva e da água do mar é inferior à soma dos pHs do caffé e do sangue humano. 25 - (UFF RJ) A um litro de água destilada se adiciona 0,100 g de NaOH. Determinar o pH da solução ressultante, supondo que não –14 ocorra variação de volume e que Kw w = 1,0 × 10 . 26 - (FM Petrópolis RJ) SOLUÇÃO – TA AMPÃO ende a permanecer o mesmo É o tipo de solução em que o pH te após a adição de ácidos ou bases fortes. As soluções-tampão têm grande importância em proccessos biológicos. Os fluidos que existem em nosso corpo são to odos tamponados. Por isso, o conhecimento das soluções- tampãão torna-se importante para os profissionais de saúde. 22 - (UFG GO) Em um laboratório, um analista misturou 1 L de u uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma soluçãão de hidróxido de sódio 0,2 mol/L. A partir das informações fornecidas, a) b) leite e lágrima lágrima água do mar e leite café e coca-cola coca-cola e leite Suponha que o médico respon nsável receba as seguintes informações da análise de um pacie ente: escreva a equação química balanceada. calcule a concentração molar e o valor do o pH da solução resultante. Use log 5 = 0,70. 4 b) c) d) e) Na interpretação dos resultados fornecidos pelo o laboratório, os valores de x, y e z são, respectivamente, Dado: log 4 = 0,60 a) b) c) d) e) maior que 7,0 e maior que 7,0 0. maior que 7,0 e menor que 7,0. 7,0 e maior que 7,0. menor que 7,0 e 7,0. 29 - (FMJ SP) Líquidos produzidos pelo organismo humano, a 25 ºC líquido intervaalo de pH 1,0 suco gástrico 0 a 3,0 7,4 ; 6,0 e 2,0 7,4 ; 8,2 e 2,5 6,0 ; 7,8 e 2,5 6,0 ; 7,8 e 2,0 4,8 ; 6,0 e 2,0 5 a 7,5 6,5 6,8 8 a 7,6 bile urina 8 a 7,0 6,8 4,8 8 a 8,4 (CRC Handbook of Chemisstry and Physics, 73.a edição.) 27 - (PUC Camp SP) Medusas Viragem de cores de diferentes indicadores ácido-base, a 25 ºC Pessoas acidentalmente atingidas por espécies venenosas de medusas, como as vespas-do-mar, apresenttam ferimentos iguais aos provocados por açoites algumas morrem de choque anafilático. Esses "ataques" nada têm a ver com fome ou agressividade: a maioria das medusas é tão cega e desajeitada que não conseguem desviar-se de seus nadadorees. Além de coletarem alimentos, algumas espéccies criam algas sob suas campânulas. Na convivência simb biótica que se estabelece, elas fornecem o alimento e, em ttroca, recebem proteção das zooxantelas, ao mesmo tem mpo que lhes proporcionam as melhores condições de crescim mento possíveis: durante o dia, a águaviva Mastigias, por exemplo o, nada perto da superfície aquática para ajudar na fotossíntesse das algas; à noite, ela desce para zonas mais profun ndas, onde a concentração de amônia é maior, e "aduba" suass protegidas. (Revista Geo, n. 25, p. 59)Na superfície aquáttica ocorre um equilíbrio químico envolvendo o CO2 (g), represen ntado a seguir: CO2 (g) + H2O (l) → ← HCO 3− (aq) + H (aq) + Em lagos de grande altitude, comparados com aaqueles ao nível do mar, +] a) b) c) diminui [H . – diminui [OH ]. aumenta [HCO 3− ]. d) e) diminui o pH. aumenta a dissolução do CO2 (g). indicador intervalo de pH H mudança de cor amarelo de alizarina R azul de bromotimol 10,1 a 12,0 6,0 a 7,6 amarela para vermelha amarela para azul verde de bromocresol 3,8 a 5,4 amarela para azul Considerando os valores médios de e pH de cada um dos líquidos –14 e que Kw, a 25 ºC, é igual a 1,0 0 × 10 , conclui-se que a – concentração de íons OH (aq) é maaior a) b) c) d) e) na urina. na bile. no leite. no suco gástrico. na saliva. GABARITO: 4) Gab: 03 1) Gab: E 2) Gab: D 3) Gab: D 8) Gab: C 5) Gab: C 6) Gab: D 7) Gab: B 12) Gab: E 9) Gab: B 10) Gab: E 11) Gab: A 16) Gab: E 13) Gab: E 14) Gab: E 15) Gab: D 20) Gab: E 17) Gab: C 18) Gab: D 19) Gab: D 21) Gab: B 22) Gab: a) HCl (aq) + NaOH (aq) → NaCll (aq) + H2O (aq) –2 b) Concentração molar: 0,05 mol/L ou 5x10 mol/L pH = 12,70 23) Gab: D 24) Gab: A 25) Gab: pH = 11.40 26) Gab: A 27) Gab: A 28) Gab: A 29) Gab: C 28 - (UEA AM) Na apresentação de um projeto de química sobree reatividade de produtos caseiros, vinagre e bicarbonato de ssódio (NaHCO3) foram misturados em uma garrafa plástica; em m seguida, uma bexiga vazia foi acoplada à boca da garrafa. A imagem apresenta o momento final do experimento. pH de soluções O pH de soluções aquosas de vinagre e o p aquosas de bicarbonato de sódio são, respectivam mente, a) saliva leite menor que 7,0 e maior que 7,0. 5
Download