LOQ - 4007 Físico-Química Capítulo 2: A Primeira Lei: Conceitos Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia – LOT E-mail: [email protected] ou [email protected] Fone: 3159-5027 Aula 3 – Termodinâmica:A primeira lei 1. Os Conceitos Fundamentais » (a) Trabalho, calor e energia » (b) A primeira lei » 2. Trabalho e Calor (a) Trabalho de expansão (b) Trocas térmica (c) Entalpia (d) Transformações adiabáticas » 3. Termoquímica (a) Variações de entalpia padrão (b) Entalpias padrões de formação (c) Dependência das entalpias de reação com a temperatura (d) Transformações adiabáticas LISTA DE EXERCÍCIOS capítulo 2 – Atkins (sétima edição) Cap. 2 - A Primeira Lei Conceitos importantes: abordagem Sistema (aberto, fechado e isolado) Vizinhanças Energia de um sistema Calor Processo exotérmico Processo endotérmico Movimento térmico Energia interna Função de estado Primeira lei da Termodinâmica Trabalho de expansão Trabalho extra ou trabalho adicional (trabalho elétrico) Expansão livre Diagrama indicador Transformação reversível Equilíbrio calorímetro Bomba calorimétrica adiabática Constante do calorímetro Capacidade calorífica a volume constante Capacidade calorífica molar a volume constante Capacidade calorífica específica Cap. 2 - A Primeira Lei Conceitos importantes: abordagem Entalpia Equação termodinâmica Calorímetro isobárico Entalpia padrão de reação Calorímetro de chama adiabático Entalpia padrão de combustão Calorímetro diferencial de varredura Lei de Hess Capacidade calorífica a pressão Entalpia padrão de formação constante Estado de referência Capacidade calorífica molar a pressão Entalpias médias constante Grupos termoquímicos Razão entre capacidades caloríficas Lei de Kirchhoff Termoquímica Entalpia padrão de transição Entalpia padrão de vaporização Entalpia de fusão Capitulo 2 1. OS CONCEITOS FUNDAMENTAIS O estudo da termodinâmica, TRANSFORMAÇÕES DA ENERGIA, divide-se naturalmente em duas partes: A primeira lei preocupa-se em observar as variações de energia e permite - nos calcular, por exemplo, quanto calor uma reação produz. A segunda lei, que é assunto do capítulo seguinte, explica porque algumas reações ocorrem mas outras não. Ambas as leis são resultados de experimentos com a matéria e são independentes de qualquer modelo que leve em conta a estrutura microscópica da matéria - você pode usar a termodinâmica mesmo se você não acredita na existência de átomos! Podemos interpretar ambas as leis em termos de modelos baseados no comportamento dos átomos e moléculas? Sim, e assim aprofundarmos nossa compreensão sobre as propriedades da matéria. Para avançar na conexão entre átomos e a matéria, temos que reconhecer que a última é constituída de grande número de átomos. Neste sentido, introduzimos a termodinâmica estatística Termodinâmica estatística É a interpretação das leis da termodinâmica em termos do comportamento de grande número de átomos e moléculas que compõe uma amostra típica. Estaremos movendo-nos entre estes dois níveis de explicação, porque um conhecimento de como o comportamento molecular contribui para as propriedades da matéria, enriquecerá nossa compreensão da termodinâmica e desenvolverá nosso conhecimento sobre as propriedades da matéria. Conceitos fundamentais da termodinâmica FOCO DE EXPOSIÇÃO É A CONSERVAÇÃO DA ENERGIA – observação experimental de que a energia não pode ser destruída nem criada. Aplicação deste princípio de conservação nas variações de energia nos processos físicos e químicos. »O »Os sistemas podem trocar energia com o exterior em termos do trabalho que podem efetuar ou do calor que pode desprender. »Liberação de energia pode ser usada para produzir calor ou proporcionar trabalho mecânico ou trabalho elétrico »Reações químicas podem proporcionar calor e trabalho ou simplesmente liberam energia que se perde. »Termodinâmica = estudo das transformações de energia, leva à discussão quantitativa de todos esses efeitos e propicia que predições úteis sejam feitas. Conceito mais importante do capítulo: ENTALPIA »É uma propriedade muito útil para contabilizar o balanço térmico de processos físicos e de reações químicas que ocorram a pressão constante Introdução a Termodinâmica Termodinâmica: Estudo dos estados estacionários da matéria e como eles diferem uns dos outros em termos de quantidade de energia Termodinâmica nos dá um conjunto de regras as quais se aplicam a qualquer objeto ou conjunto de objetos independentemente do que são, do que eram, ou do eles serão no futuro. Existe a disponibilidade de algumas hipóteses (relativamente) simples e definições, bem como uma estrutura matemática que permita aos cientistas e engenheiros reduzir as situações muito complexas a problemas relativamente simples. Applicações: Aquecimento e refrigeração de edifícios Baterias (trabalho químico) Planta/projeto de fábrica Eficiência do motor Transferência de energia biológica Isolantes e condutores Introdução a Termodinâmica Termodinâmica: O estudo dos padrões de variação de energia, onde TERMO refere-se ao calor, e DINÂMICA refere-se aos padrões de mudança (a) (b) (a) Energia de conversão Direções da variação e estabilidade molecular Up = mgh (b) Estrutura da proteína e enovelamento Up + Ue calor, luz, som após o impacto Ue Sistemas e Vizinhanças Sistema: O objeto ou a região de interesse (volume de controle) Vizinhanças: Parte externa do sistema onde fazemos as observações e as medidas. O tipo de sistema depende das características da fronteira entre o sistema e suas vizinhanças – ex., a energia, que é a capacidade para realizar trabalho, pode ser transferida entre o sistema e o ambiente. Sistema Aberto: Matéria pode passar através das fronteiras Sistema Fechado: Matéria não pode passar através das fronteiras Sistema isolado: Sistema fechado sem contato mecânico e térmico com suas vizinhanças (este é um sistema ideal) Sistemas abertos e fechados podem trocar energia com as respectivas vizinhanças. Ex. um sistema fechado pode se expandir e elevar um peso situado nas suas vizinhanças;também pode ceder calor para elas se estiver em temperatura mais elevada. Como vimos: Em termodinâmica, o mundo está dividido em um sistema e suas vizinhanças. Um sistema aberto pode trocar matéria e energia com suas vizinhanças; um sistema fechado pode trocar somente energia; um sistema isolado não pode trocar nada. Trabalho, Calor e Energia Energia: Capacidade de efetuar trabalho - a energia de um sistema pode ser alterada pelo trabalho e calor Unidades: joules (J) ou para energia molar kJ mol-1 Trabalho: Transferência de energia que faz uso do movimento organizado das moléculas. Há trabalho quando um corpo é deslocado contra uma força que se opõe ao deslocamento. Fazer trabalho é equivalente a elevar um peso em algum lugar nas vizinhanças do sistema. Calor: Transferencia de energia que faz uso do movimento caótico (movimento térmico) das moléculas. Se a energia de um sistema se altera como resultado da diferença de temperatura entre o sistema e suas vizinhanças, se diz que a energia foi transferida na forma de calor. Definições Termodinâmicas de Trabalho e calor Trabalho:Trabalho (w) é a energia transferida através da fronteira de um sistema termodinâmico durante uma mudança em seu estado e que poderia ser convertida completamente em "levantamento de peso" na sua vizinhança (ou seja, o movimento de uma massa contra uma força oposta). Convenções de sinais para o trabalho: Trabalho é feito pelo sistema sobre a vizinhança. Trabalho é feito no sistema pela vizinhança. . Calor: Calor (q) é a energia que é transferida através da fronteira de um sistema termodinâmico durante uma mudança em seu estado em virtude de uma diferença de temperatura entre o sistema e sua vizinhança. wsistema < 0 wsistema > 0 Convenções de sinais para o calor: qsistema < 0 qsistema > 0 Calor transferido do sistema para a vizinhança. Calor transferido para o sistema a partir da vizinhança. Mais sobre Calor Sistema com fronteiras Diatérmicas (Diabático): Possui uma fronteira permeável à passagem de energia na forma de calor – sistema em contato térmico com sua vizinhança Sistema com fronteiras Adiabáticas: Possui uma fronteira que não permite a transferência de energia na forma de calor. (a) Processo Endotérmico: Processo que absorve energia na forma de calor (b) Processo Exotérmico: Processo que libera energia na forma de calor (c) Processo Endotérmico num sistema com fronteiras diatérmicas: Há entrada de energia no sistema na forma de calor (d) Processo Exotérmico num sistema com fronteiras diatérmicas: Provoca liberação de energia, na forma de calor, para as suas vizinhanças Mais sobre Calor (e) Processo Endotérmico num sistema com fronteiras adiabáticas: A temperatura do sistema diminui (f) Processo Exotérmico num sistema com fronteiras adiabáticas: provoca a elevação da temperatura do sistema Em termodinâmica, a capacidade total de um sistema realizar trabalho é chamada sua energia interna, U. Um gás comprimido tem mais energia interna antes de se expandir que depois da expansão Uma mola comprimida tem mais energia interna que uma mola descomprimida. Uma bateria carregada tem mais energia interna que uma bateria descarregada. O vapor tem uma energia interna mais alta que a mesma massa de água fria. Energia Interna Energia Interna (U): A energia total de um sistema em um determinado momento – é a soma das energias cinética e potencial das moléculas que compõem o sistema. Variação de energia interna(ΔU): É quando o sistema passa do estado inicial i, com energia enterna Ui, para o estado final f, com energia interna Uf, é simbolizada por ∆U: ∆U = Uf - Ui Energia interna é: uma função de estado: seu valor depende exclusivamente do estado em que está o sistema e não depende da forma pela qual o sistema chegou a este estado. Em outras palavras é uma função das propriedades que identificam o estado que está o sistema. Qualquer alteração de qualquer variável de estado (ex. pressão) provoca uma modificação da energia interna. uma propriedade extensiva: depende da quantidade de matéria. Propriedades cujos valores são aumentados / diminuídos em proporção direta com a ampliação / redução do sistema. Lembre-se que uma propriedade intensiva é independente da quantidade de matéria - todas as forças motrizes termodinâmicas são selecionadas entre as propriedades deste tipo. Como podemos descrever a energia interna em termos das propriedades individuais dos átomos e moléculas que constituem o sistema? Energia interna é a energia armazenada em um sistema como energia cinética e energia potencial. A que a energia cinética é a energia devida ao movimento, e quanto mais rapidamente a molécula se move, maior sua energia cinética. O aumento na velocidade média das moléculas do gás corresponde a um aumento na energia cinética total das moléculas, e portanto há um aumento da energia interna do gás. O caso é que geralmente um sistema a alta temperatura tem maior energia interna que o mesmo sistema a uma temperatura mais baixa. Moléculas podem mover-se de diferentes maneiras em um gás fazendo contribuições diferentes à sua energia cinética A energia cinética de um átomo ou molécula quando se desloca através do espaço é chamada de energia cinética translacional. Moléculas (em contraste com átomos) podem armazenar também energia como energia cinética rotacional a energia cinética originária de seu movimento de rotação. Um terceiro modo de armazenar energia cinética para moléculas está na oscilação de seus átomos uns em relação aos outros: esta contribuição é chamada de energia cinética vibracional. Eis alguns movimentos independentes das moléculas. Moléculas podem mover-se de diferentes maneiras em um gás fazendo contribuições diferentes à sua energia Ainda que empurrar um pistão afete somente a energia translacional das moléculas de gás diretamente, colisões moleculares rapidamente asseguram que rotações são excitadas levando a estados de energia mais alta, de modo que as moléculas também armazenam energia interna nos seus modos rotacionais de movimento. Vibrações moleculares não são excitadas a temperaturas próximas à temperatura ambiente porque elas requerem energia muito maior. A contribuição de cada grau de liberdade, cada modo diferente de movimento, pode ser estimado a partir da temperatura. COMO FAZEMOS ISTO? Moléculas podem mover-se de diferentes maneiras em um gás fazendo contribuições diferentes à sua energia cinética COMO FAZEMOS ISTO? Um teorema fundamental da mecânica clássica chamado de teorema da equipartição (que não será deduzido aqui) estabelece que a energia média de cada grau de liberdade de uma molécula a uma temperatura T é igual a 1/2kT. Moléculas podem mover-se de diferentes maneiras em um gás fazendo contribuições diferentes à sua energia cinética Nessa expressão simples, k é a constante de Boltzmann, uma constante fundamental com valor 1,38066 x 10-23 J.K-1. A constante de Boltzmann está relacionada com a constante dos gases por R= NA k onde NA é a constante de Avogadro. O teorema da eqüipartição é um resultado da mecânica clássica, portanto podemos usá-lo para o movimento translacional e rotacional das moléculas à temperatura ambiente e acima, onde a quantização não é importante, mas não podemos usá-lo com segurança para o movimento vibracional, exceto a altas temperaturas. Os próximos comentários aplicam-se portanto aos movimentos translacional e rotacional. Moléculas podem mover-se de diferentes maneiras em um gás fazendo contribuições diferentes à sua energia cinética Os modos translacional e rotacional de moléculas e respectivas energias médias à temperatura T. (a) Um átomo ou molécula pode experimentar movimentos translacionais em três dimensões. (b) Uma molécula linear pode também girar em tomo de dois eixos perpendiculares à linha dos átomos. (c) Uma molécula não-linear pode rotar em tomo de três eixos perpendiculares. A origem molecular da energia interna Mudanças na energia interna podem ocorrer também porque a energia potencial dos átomos e moléculas variam. A molécula de um gás ideal tem energia potencial nula porque não importa quanto as moléculas estejam perto umas das outras na amostra. Portanto compressão e expansão de um gás ideal não modifica a energia potencial das moléculas; ou seja, para um gás ideal, a energia interna é independente do volume. Uma molécula em um líquido ou em um sólido, entretanto, interage com seus vizinhos, e a energia potencial traz uma importante contribuição para a energia interna. A origem molecular da energia interna Quando apertamos uma bola de borracha, fazemos as moléculas ficarem mais próximas, sua energia potencial aumenta, e a energia interna da bola aumenta. Em outras palavras, quando realizamos trabalho sobre o sistema (comprimindo a borracha), sua energia interna (sua capacidade de realizar trabalho, voltando à sua forma original) aumenta. A energia interna é uma propriedade extensiva, portanto depende somente da quantidade de substância. Por exemplo, uma amostra de 50 g de uma substância tem duas vezes mais energia interna que uma amostra de 25 g da mesma substância sob as mesma condições. Assim temos... A energia interna é armazenada como energias cinética e potencial moleculares. O teorema da equipartição pode ser usado para estimar as contribuições translacional e rotacional à energia interna de um gás ideal. Assim temos... Trabalho é a transferência de energia para um sistema por um processo que é equivalente ao aumento ou ao abaixamento de um peso. A energia interna de um sistema pode ser mudada pela realização de trabalho: ∆U =w. Calor é a transferência de energia como resultado de uma diferença de temperatura. Quando a única transferência de energia é como calor, ∆U = q. Primeira Lei da Termodinâmica Energia interna Energia total de um sistema (cinética + potencial) é chamada de energia interna (U) » A mudança na energia de um estado inicial , i, para o estado final, f, DU é: DU = Uf – Ui » A energia interna é uma função de estado Valor depende somente do estado em que está o sistema e não da forma pela qual o sistema chegou a este estado - caminho independente. Em outras palavras é uma função das propriedades que identificam o estado em que está o sistema. Qualquer mudança no estado da variável (ex. pressão) resulta em uma mudança em U. A energia interna é uma propriedade extensiva Primeira Lei da Termodinâmica Energia interna » » » » » » Unidade de medida para energia (U, trabalho, Calor) é o joule (J) [kg m2 s-2] Variação na energia interna molar, ∆Um, medem-se, comumente, em quilojoules por mol (kJ mol-1) Outras unidades de energia também são também usadas, mas são mais comuns em outros campos, diferentes da termodinâmica. Como exemplo temos o 1 eletron-volt (1 eV) definido como a energia cinética adquirida por um elétron que é acelerado, a partir do repouso, por uma diferença de potencial de 1 V. 1eV ≈ 0,16aJ (onde 1 aJ=10-18J). Muitos processos químicos tem uma energia de vários elétrons-volts. A energia de 1 cal é o suficiente para elevar a temperatura de 1g de água de 1 °C. Caloria (cal) = 4,184 J (EXATAMENTE) Em uma escala molecular a maioria da energia interna de um gás é devido ao movimento dos atómos (3/2 kT ~3.7 kJ/mol - 25°C – da distribuição de Boltzman ) assim como a temperatura aumenta U tb aumenta. Primeira Lei da Termodinâmica Energia interna Energia interna é alterada tanto pelo trabalho quanto pelo calor que atuam sobre o sistema » Se o trabalho é realizado sobre o sistema (entrada de calor), U aumenta » Se o sistema realiza trabalho (saída de Calor), U diminui » Isto implica que para um sistema isolado U é contante . Energia interna de um sistema isolado é constante. (Primeira da Termodinâmica). Matematicamente para a Primeira Lei temos: DU = q + w Onde q = calor transferido para o sistema w = trabalho realizado sobre sistema » Impossibilidade de um moto-perpétuo de primeira especie! (You can’t win!) Para um sistema isolado realizando trabalho, diminui U » Sistema isolado DU = 0 Primeira Lei da Termodinâmica Enunciado formal da primeira lei O trabalho necessário para elevar um sistema de fronteiras adiabáticas de um estado até outro estado tem o mesmo valor, qualquer que seja o tipo de trabalho (ex. mecanico ou elétrico). •Num sistema com fronteiras adiabáticas, uma certa quantidade de trabalho provoca sempre a mesma modificação de estado, embora sejam diferentes os processos de execução do trabalho. •Esta independência diante do processo acarreta a existência de uma função de estado, a energia interna. • A variação na energia interna é semelhante á variação de altitude na ascensão de uma montanha, que não depende da trilha percorrida pelo montanhista. Primeira Lei da Termodinâmica A definição de trabalho mecânico Imagine que se elimine o isolamento térmico do sistema e que suas fronteiras passem a ser diatérmicas. A variação de energia interna é a mesma que a anterior, pois não depende destes estados, uma vez que U é uma função de estado, MAS O TRABALHO AGORA NÃO É MAIS CONSTANTE COMO NO CASO ANTERIOR (quando o sistema era adiabático). •A diferença entre o trabalho, nos dois casos, é definida como sendo o calor absorvido no processo: q= wad-w •Como por definição ∆U é por definição igual a wad, a expressão da energia trocada pelo sistema em forma de calor é q= ∆U- w (expressão equivalente da primeira lei que vimos anteriormente) Primeira Lei da Termodinâmica Trabalho de expansão Na forma diferencial, a primeira lei fica: dU = dq + dw Trabalho de expansão é realizado pela variação no volume » Considere o pistão a direita, mudança no volume é Apistãodz (dV); força é pexterna dw pex dV trabalho total w V2 V1 pex dV Se pex = 0 (ex. vacuum),w = 0 (EXPANSÃO LIVRE) » Se pex = constante (ex. atmosfera), pex é removida da p integral e w = - pex ∆V (EXPANSÃO CONTRA PRESSÃO CONSTANTE) P Grafico de um diagrama indicador de p versus V onde área entre os volumes é trabalho Nota: outro tipo de trabalho (trabalho sem expansão) tem expressões similares (tabela 2.1). Trabalho total é a soma dos componentes individuais. » ex Area = pex DV V1 V V2 Primeira Lei da Termodinâmica Tipos de Trabalhos Primeira Lei da Termodinâmica Trabalho de expansão – EXPANSÃO CONTRA PRESSÃO CONSTANTE DIAGRAMA INDICADOR O trabalho efetuado por um gás que se expande contra uma pressão externa contante, pex é igual ao da área sombreada neste exemplo de um DIAGRAMA INDICADOR Primeira Lei da Termodinâmica Trabalho de expansão – EXPANSÃO REVERSÍVEL Um processo reversível é aquele que é conduzido ao longo de caminho no qual todos os estados intermediários são estados de equílibrio. » Um estado de equílibrio é aquele no qual alterações infinitesimais em direções opostas resultam em mudança oposta no estado. Equílibrio térmico entre dois sistemas numa mesma temperatura. Transformação reversível são tipicamente lenta. Expansão Reversível » pex igual a p (pressão do gás) no caminho de expansão. V2 dw pdV ....e....w pdV » Temos, V1 » Se nós conhecemos como p varia com V nós podemos avaliar a integral Variação dp com V é uma equação de estado do gás [ex., p =nRT/V (gás ideal)] Primeira Lei da Termodinâmica Trabalho de expansão – EXPANSÃO ISOTÉRMICA REVERSÍVEL Em uma expansão isotérmica reversivel, a temperatura não muda (constante) » » T é uma constante , portanto pode ser removida da integral (juntamente com n e R). Para gás ideal, w = -nRT ln (Vf/Vi) Se volume final > inicial (expansão), w < 0 Sistema tem realizado trabalho sobre a vizinhanças, energia interna (U) diminui Se o volume final < inicial (compressão), w>0 Sistema realizou trabalho sobre ele, U aumentou Note que quando T aumenta, |w| aumenta. w pdV V2 V1 nRT dV V 1 w nRT dV V w nRTln(V) w V2 V1 V2 V1 Vf Vi V w nRT ln V f i Primeira Lei da Termodinâmica Trabalho de expansão - Expansão Reversível vs. Irreversível Expansão irreversivel: w= = -pexDV Expansão Reversível (isotérmica): w=-nRTln(Vf/Vi) » » » Qual é o maior? Considere o diagrama indicador Trabalho(rev.) = Área sob a curva Trabalho (irrev.) = Área sobre o retângulo Trabalho (rev.) > W (irrev.) Trabalho reversível é o máximo que poderia ser realizado Verdadeiro para trabalho PV Verdadeiro para todos os trabalhos. Primeira Lei da Termodinâmica Trabalho de expansão - Expansão Reversível vs. Irreversível O trabalho efetuado por um gás perfeito numa expansão isotérmica e reversível é dado pela área subentendida pela isoterma p=nRT/V. O trabalho feito na expansão anterior é dado pela área retangular, com sombra laranja Veja que o trabalho reversível é maior que o irreversível. Trocas Térmicas Calorimetria Relembrando: dU = dq + dw » Se o trabalho de expansão é dwexp e dwextra é outro trabalho realizado (eletrico, magnetico, etc.), então dw = dwexp + dwextra » dU = dq + dwexp + dwextra Se V é constante, dwexp é zero deste que nenhum trabalho PV possa ser realizado. Trocas Térmicas Calorimetria Assumir dwextra igual a zero, então dU = dq = qv » qv é a alteração em q a volume constante (isocórica) » Ou seja, medição na mudança de calor em um sistema a volume constante dá uma medida da alteração na energia interna. » Este processo de medição da variação do calor é conhecido como calorimetria Um recipente a volume constante para pedir variação de calor é uma bomba calorimétrica Experimentos em laboratório Normalmente, a elevação da temperatura é medida após a queima de substancia em calorímetro (dV é constante, mas P muda na bomba) Em uma bomba calorímetrica, DT a qv Esta proporcionalidade é quantificada pela calibração, normalmente pela combustão de uma substância conhecida Trocas Térmicas Calorimetria ∆U=qv DT a qv Conclui-se então, que ao se medir a energia térmica fornecida a um sistema a volume constante (q> 0) ou cedida por um sistema a volume constante (q<0), quando ocorre uma mudança no estado do sistema, estamos, realmente, medindo a variação da energia interna nesta mudança. Trocas Térmicas Calorimetria Bomba calorimétrica a volume constante. A bomba é o vaso central, com paredes robustas capazes de suportar grandes pressões. O calorímetro (cuja capacidade calorifica é conhecida) é toda a montagem que aparece no esquema. Para garantir a adiabaticidade da operação, o calorímetro trabalha imerso num banho de água cuja temperatura é permanentemente ajustada de modo a ser igual a do calorímetro em cada etapa da combustão. Trocas Térmicas Capacidade calorífica Se o V é constante, U aumenta quando a T aumenta. A razão da alteração de U em qualquer T a volume constante é definida por (dU/dT)V e é chamado de calor especifico, CV » CV(A) não é igual a Cv(B) geralmente menor se TA < TB » Note que o volume é constante. Se CV muda (T pode mudar) A notação é uma derivada parcial. Uma derivada parcial é o coeficiente angular calculado com todas as variáveis sendo mantidas constantes, exceto uma. Neste caso, a energia interna com a T e com o V da amostra, mas estamos interessados na variação com a temperatura, mantendo-se constante o volume. Trocas Térmicas Capacidade calorífica A energia interna de um sistema aumenta com a elevação da temperatura. Este gráfico mostra a variação da energia interna quando o sistema é aquecido a volume constante. O coeficiente angular da tangente à curva em qualquer T é a capacidade calorífica a volume constante naquela temperatura. Observe que, para o sistema que é ilustrado, a capacidade calorífica é maior em B do que em A A energia interna de um sistema se altera com o volume e com a temperatura, talvez conforme a superfície representada neste gráfico. A variação da energia interna com a T, a um certo volume constante, está representada pela curva que é paralela a T. O coeficiente angular desta curva, em qualquer ponto, é a derivada parcial (dU/dT)V Trocas Térmicas Capacidade calorífica Se CV é uma propriedade extensiva (100 g de água tem capacidade calorífica 100 vezes maior do que 1 g de água – por isso precisam de 100 vezes a quantidade de calor fornecida a 1 g de água para sofrer a mesma variação de T). » Capacidade calorífica molar a volume constante, CVm, é a capacidade calorífica por mol de substância e é uma propriedade intensiva (todas as grandezas molares são intensivas) » Em certas aplicações – capacidade calorífica específica = calor específico = capacidade calorífica da amostra dividida pela sua massa geralmente em gramas. Ex. calor específico da água é 4JK-1g-1 Trocas Térmicas Capacidade calorífica » Uma razão de alteração de CV com T normalmente é pequena em torno da temperatura ambiente, pode-se assimir que é constante. Isto significa que dU = qV= CV dT ≈ CV DT Pode-se estimar CV pela determinação da quantidade de calor fornecido a amostra Esta relação propicia uma forma simples de medir-se a capacidade calorífica de uma mostra – uma certa quantidade de calor é fornecida á amostra e mede-se a elevação da T que é provocada. A razão entre o calor fornecido e a elevação de T dá a capacidade calorífica da amostra. Trocas Térmicas Capacidade calorífica Por ser qV ≈ CV DT, para uma determinada quantidade de calor forncecido (qv), maior será CV, a menor DT (amostra tem grande capacidade para o calor) Na transição de fase (ponto de ebulição) DT = 0 assim CV = ∞ Neste caso, a T não se altera embora se forneça calor ao sistema: a energia é usada para impelir a transição de fase endotérmica (ex. vaporização da água) e não para a elevação da Temperatura. A temperatura de uma transição de fase é infinita = discussão detalhada no curso de termodinâmica química. Entalpia Definição A variação da energia não é igual ao calor recebido pelo sistema quando o volume não é contante. Nesta circunstâncias parte da energia fornecida como calor retorna ás vizinhanças na forma de trabalho de expansão e então dU é menor do que dq. Neste caso, o calor fornecido a pressão constante é igual á variação de outra propriedade termodinâmica do sistema, a ENTALPIA. Entalpia Definição Se o trabalho PV pode ser realizado pelo sistema, a pressão constante, V varia » Parte da energia interna perde-se através do trabalho » U=q-pV ou q = U+ pV » dU < dq, se o trabalho é realizado; dU=dq, se não há trabalho Entalpia Definição Definir uma nova variável, H, tal que H= U + pV » H é chamado entalpia Como U, H é uma função de estado » A pressão constante p, dH = dU +pdV Esta é uma função importante porque a maioria dos experimentos são realizados a pressão constante, ex. Pressão dH dU d ( pV ) atomosférica dH dU pdV Vdp( produto) Entapia é o calor fornecido a pressão const. p,dP 0assim contante dH dU pdV ouparaumalateraçãofi nita ) Se pdV=0, dH=dq ou DH=qP Assim como Cv, Cp é definido como DH DU pDV dqp/dt = (dH/dT)p Medida de Variação de Entalpia Calorímetro isobárico mede a variação de temperatura a pressão constante. » Diferente de uma bomba calorimétrica na qual o volume é restrito Você pode utilizar uma bomba calorimétrica para medir entalpia pela conversão de DU em DH » Veja experimento 1 Assumir igualdade entre a entalpia molar e a energia interna Isto é verdadeiro para a maioria dos sólidos e líquidos. Se o processo envolve somente sólidos e líquidos DU ≈ DH Calcule o termo pV baseado em diferentes densidades (Exemplo 2.2) Calorímetro diferencial de varredura (veja Atkins, p. 48) Termograma: gráfico de Cp vs. temperatura Picos correspondem a variação na entalpia Área no pico = DH Normalmente requerem pequena massa (mg) de amostra e elevadas temperaturas. Medida de Variação de Entalpia Um calorímetro de chama adiabático consiste em um combustor que fica imerso num banho de água que é agitado. A combustão ocorre quando uma quantidade conhecida de reagente alimenta a chama. Acompanha –se então, a elevação da temperatura. Medida de Variação de Entalpia Calorimetro diferencial de varredura. A amostra e o material de referencia são aquecidos em dois compartimentos idênticos mas separados. A saída é a diferença de potência que é necessária para manter os dois compartimentos na mesma temperatura quando a temperatura do comportamento da amostra se altera. Termograma Típico de Calorímetro Diferencial de Varredura (DSC) Cp(dH/dt) mJ/s Thermogram exothermic Glass transition melting crystallization endothermic Temperature (K) Source: www.chem.neu.edu/Courses/U331/CHM1222DSC.ppt Cálculo de Entalpia Gás Ideal » Uma vez que o termo PV para gás ideal é nRT, DH = DU +pV = DU +nRT Se uma reação varia a quantidade de gás, o termo PV torna-se (nfinal -ninicial)RT or DH = DU +DngRT, onde Dng= nfinal -ninicial DH - DU = DngRT Nota: sinal de Dng é importante Variação de entalpia pode estar diretamente relacionada com a entrada de calor. Veja o exemplo a seguir. » Cálculo de Entalpia Exemplo 2.3: Calcule a variação de energia interna molar e variação de entalpia a 373,15 quando 0,798 g de água é vaporizada pela passagem de 0.5A a 12V através de uma resistencia em contato com a agua por 300 segundos. Calorentrada q p q p 0.5 Ax12Vx 300s q p 1800 A V s 1800 J EntalpiaMo lar DH m q p nmoles 0.798 g DH m 1800 J 1 18 g mol DH m 41,000 J mol 1 41kJ mol 1 DH DU PV DU Dn RT g DU DH Dn RT g DU DH RT m m DU 41kJ mol x8.314J K mol 373.15K 1 1 1 m DU 41kJ mol 3.141kJ mol 1 m DU 38kJ mol m 1 1 Variação da Entalpia com a Temperatura (Cp) O coeficiente angular da curva de entalpia contra temperatura, a pressão contante é a capacidade calorífica a pressão constante H C T p p Propriedade extensiva » Cp,m, a capacidade calorífica molar é uma propriedade intensiva » Assim como U e Cv, dH = Cpdt, ou para intervalos finitos DH=CpDT » Também qp = CpDT, devido a pressão contante DH= qp Isto assume que Cp pode ser ignorada se o intervalo de T for pequeno Especial para gases Expressão impírca conveniente quando for necessário considerar Cp Cp,m= a + bT +(c/T2) (a, b, c são constantes que dependem da sustância e independentes da T(tabela 2.2 e final livro)) Se Cp não for constante com T, DH ≠ CvDT E agora o que acontece ???? Variação da Entalpia com a Temperatura (Cp) Se Cp varia com a temperatura, deve-se integrar nos limites de temperatura de interesse. » Exemplo: Assumir Cv = a + bT +(c/T2) c dH C dT a bT T p 2 c dH a bT T H ( T2 ) T2 H (T1) T1 2 b 1 1 dH a(T T ) (T T ) c( ) 2 T T H ( T2 ) 2 2 H (T1) 1 2 2 1 2 1 b 1 1 H(T ) H(T ) a(T T ) (T T ) c( ) 2 T T 2 1 2 1 2 2 2 1 2 1 O coeficiente angular da tangente á curva da entalpia de um sistema mantido a pressão constante contra a temperatura é igual á capacidade calorífica a pressão constante. O coeficiente angular pode variar com a temperatura, quando a capacidade calorífica varia com a temperatura. Deste modo, as capacidades caloríficas em A e B são diferentes. No caso,dos gases, o coeficiente angular da curva da entalpia contra a temperatura, numa determinada T, é maior do que o coeficiente angular da curva da energia interna contra a T, pois Cpm é maior do que Cvm Relação entre Cv e Cp (Falaremos mais sobre este assunto no capítulo 3) Na maioria dos casos Cp > Cv » Para gases perfeitos, Cp = Cv + nR Isto equivale a uma diferença de ~8 JK-1mol-1 Expansão Adiabática de um Gás Ideal Trabalho realizado, U diminui, portanto T diminui. Para calcular o estado final (Tf eVf) assumir um processo em duas etapas » » Lembre-se U é uma funão de estado, e não importa como se chegou lá. A variação de U no processo será igual à soma da variações para as duas etapas. Etapa 1: Volume se expande a T constante » Variação da energia interna= 0 uma vez que é independente do volume que as moleculas ocupam. Etapa 2: A Temperatura do sistema é reduzida (Ti a Tf) a V constante Adiabática para q = 0 Se Cv é independente da temperatura, trabalho adiabático = wad= CvDT DU = q + wad = 0 + CvDT= CvDT Isto significa que que para uma expansão adiabática o trabalho realizado é somente proporcional as temperaturas inicial e final. A relação entre volumes inicial e final pode ser derivado utilizando o que aprendemos sobre expansões reversível adiabática e gases perfeitos Expansão Adiabática de um Gás Ideal Relação entre T e V Dado dq = 0 (adiabático) e dw = -pdV (expansão reversível) » dU = dq + dw =-pdV [1] Para gas perfeito dU = CvdT [2] Assim, combinando [1] and [2], CvdT = -pdV [3] Para um gás ideal, pV = nRT, assim [3] torna-se CvdT = -(nRT/V)dV [4] ou, rearranjando, (Cv/T)dT = -(nR/V)dV [5] Para obter a relação entre Ti, Vi e Ti, Vi [5] deve ser integrada » » Ti corresponde a Vi Cv independente de T O trabalho adiabático, wad= CvDT, pode assim ser calculado uma vez que esta relação é encontrada Integrando (Cv/T)dT = -(nR/V)dV Cv Tf Ti Vf 1 1 dT nR dV V i T V Tf Cv ln Ti V nR ln f Vi Cv T f ln nR Ti Tf ln Ti Cv nR Vi ln V f Tf ln Ti Vi ou , T f Ti V f 1 c V nR ln i V f V ln i V f c , onde c Cv nR Trabalho Adiabático, wad, e Temperatura wad Cv DT wad Cv T f Ti 1 c Vi But , T f Ti V f Vi wad Cv Ti V f Vi wad CvTi V f , onde c Cv nR 1 1 c c Ti 1 C=3 Variação de Temperatura quando um gás perfeito se expande reversível e adiabaticamente. As curvas estão identificadas pelos diferentes valores de c= Cv,m/R. Observe que a queda de temperatura é mais acentuada para os gases com a capacidade calorífica molar pequena. Variação de pV Durante Expansões Adiabáticas 1 c T f Vi piVi Ti Ti V f Paraumgásideal masapartirdeuma exp ansãoadiabática ou p f V f Tf Ti V f T f Vi 1 c piVi V f 1 nR onde p f V f Vi c Cv mascomovimosanterior menteRéC p Cv assim assim, nR C p Cv C p 1 1 Cv Cv Cv 1 piVi V f p Vf ou i p f V f Vi p f Vi rearranjando, Esta relação mostra que o produto, pV não se altera a medida que vc passa por uma expansão adiabática. Para um gás ideal, ,a relação das capacidades calorificas é >1 desde que Cp,m = Cv,m +R = Cp,m /Cv,m = (Cv,m+R) /Cv,m = 1 +(R /Cv,m) Para gás ideal monoatómico, Cv,m= 3/2 R, assim = 5/2 » Para um gás poliatómico de moléculas não-lineares (que podem rodar, além de executar rotação) Cv,m= 3 R, so = 4/3 » Assim, piVi p f V f 1 c Curvas de P vs V para uma transformação reversível adiabática, são conhecidas como adiabáticas. » p a V, onde g>1 » Lembre-se isoterma, p a V » Adiabáticas tem quedas mais acentuadas que isotermas. Uma adiabática representa a variação da pressão com o volume quando o gás se expande adiabaticamente. a) Adiabáticas de um gás perfeito numa expansão reversível. b) Observe que a pressão tem uma queda maior numa adiabática do que numa isoterma, pois na primeira há uma diminuição da T. Figura incorreta: expansão adiabática A figura da esquerda esta incorreta para uma expansão adiabática, visto que a temperatura deve cair durante uma expansão. A figura esta errada na sexta e sétima edição em inglês, mas já foi modificada na sétima versão em português e oitava (direita).
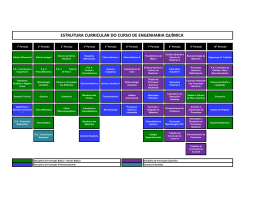
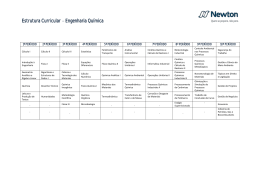
Download