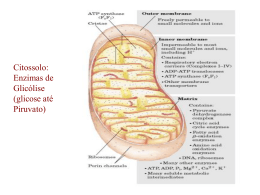
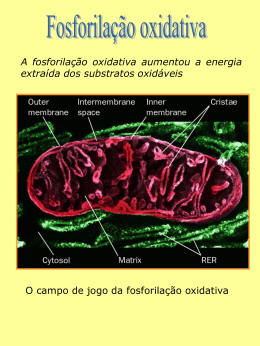
Aula 1 Termodinâmica aplicada a bioenergética A Revolução IndustrialPreponderam a produção de bens de consumo, especialmente têxteis, e a energia a vapor. Antoine-Laurent de Lavoisier (26 August 1743 – 8 May 1794) Se a respiração e a queima são a mesma reação química, então deve existir uma proporcionalidade entre as quantidades de CO2 e de calor produzidas ... Calorímetro de Lavoisier-La Place “A respiração é portanto uma combustão, muito lenta é verdade, mas de qualquer forma perfeitamente semelhante à combustão do carvão ou de qualquer outra matéria orgânica. Ela ocorre no interior dos pulmões sem produzir luz perceptível, porque a matéria liberada pelo fogo é imediatamente absorvida pela umidade dos tecidos”. (Lavoisier, 1787, vol. II, 331) Corpo + O2 CO2 + H2O + Calor Lavoisier (Tratado de Quimica Elementar, 1789) Lei da conservação das massas: “Matéria não se cria nem se destroi, se transforma” Guilhotinado em 8 de Maio de 1794, pelo tribunal revolucionário METABOLISMO Conjunto de reações químicas que ocorrem nas células ou no interior de organismos vivos. Objetivos do metabolismo: Produzir energia química em forma de ATP e NADH (NADPH, FADH2) contida nos alimentos Para sintetizar moléculas complexas partindo de precursores simples = biosíntese Para realizar uma trabalho (ex: contração muscular) PARA SE AFASTAR DO EQUILIBRIO!!!!!!!!!!!!!!! Termodinâmica • Primeira lei da termodinâmica: princípio da conservação de energia. “Para qualquer transformação física ou química, a quantidade total de energia no universo permanece constante, a energia pode mudar de forma ou ser transportada de uma região para outra; entretanto, ela não pode ser criada ou destruída.” • Segunda lei da termodinâmica: tendência do universo à desordem crescente. “Em todos os processos naturais, a entropia do universo aumenta.” Células = Sistemas abertos Sistema tende a ir para um aumento da desorganização Como sabemos se a reação acontece espontáneamente? Qual ocorre espontaneamente, qual libera energia E qual precisa de energia para acontecer? Reação química Quanto temos de um produto e de um reagente Keq- expressão de ação de massas Keq= [produtos]/ [reagentes] Coeficientes viram exponenciais e soma (+) vira produto Ex. 2CO2 2HI 2CO + O2 H 2 + I2 Numa solução aquosa H2SO4 2H+ (aq) + SO42- Coloquemos numeros • 2CO2 • • • 2CO2 + O2 CO2= 4.0M CO = 2.0M O2= 1 M • Se a Keq aumenta, mais produtos são feitos e a reação chega mais longe • Keq = 1 esta no equilibrio • Keq menor a um menos produto formou • Keq infinito reação terminou não tem mais reagentes Isto depende da temperatura • Mas com a Keq podemos saber se a reação acontece ou não? • Termodinamica entropia e entalpia Espontaneidade das reações Entropia (S) Energia Livre de Gibbs (G) DG = DH - TDS Entalpia (H) Entropia- Organização – Probabilidade ex. Gas liquido e solido Entalpia- Tipo de ligações químicas Reação favorável Reação desfavorável Entalpia -DH (exotermica) + DH (endotermica) Entropia +DS -DS NaOH(sol) ↔ Na+ (aq) + OH- (aq) DH (KJ)=-44.5 Entalpia –DH Favoravel ou desfavorável? _________________ Entropia (solido para aquoso) Favoravel ou desfavorável? _________________ Se disolvemos na agua: KNO3(sol) ↔ K+ (aq) + NO3 (aq) DH (KJ)=38 Entalpia Favoravel ou desfavorável? _________________ Entropia (solido para aquoso) Favoravel ou desfavorável? _________________ Energia livre de Gibbs G – energia livre de Gibbs H – entalpia S - entropia Equilíbrio: aA + bB R=8,314472 J/ K mol R=1,987cal /K mol cC + dD Reação Química DGo' (kcal/mol) Fotossintese 6CO2 + 6H2O --> glicose + 6O2 +686 Hidrólise de sacarose Sacarose + H2O --> glicose + frutose -7.0 Hidrólise de glicose glicose + 6O2 -->6CO2 + 6H2O -686 Conversão de ATP a ADP ATP + H2O --> ADP + fosfato -7.3 Esterificação glicose + fosfato --> glicose 6fosfato + H2O +3.3 ácido palmítico palmitato (C16H3202)+31O2 --> 16CO2 + H2O +2,398 Quantidade de energia livre para realizar trabalho DG < 0 (-) liberação energia = Exergonico DG > 0 (+) absorção energia = Endergonico 1 caloria = 4,1858 Joules 1,123 kcal.min-1 0.98 21,0 CONSTRUCTORE http://ltc.nutes.ufrj.br/constructore/ BIOQUIMICA II FARMACIA-TURMA MONICA Transdução de energia fototróficos quimiotróficos • De onde tiramos a nossa energia? ATP: “moeda” energética Hidrólise do ATP -7.27 kcal/mol Compostos de alta energia DG’º hidrólise < -25 kJ/mol Os fosfoésteres e os fosfoanidridos Fosfoésteres Fosfoanidridos ATP Hidrólise da fosfocreatina -10,27 kcal/mol = molécula de estoquagem de energia Rotas metabólicas: conjunto de reação que produz ou degrada um determinado produto (substrato) ou cunjunto de produto ex: glicólise dois tipos de rotas: - catabólicas (onde há degradação, ou “quebra” de compostos); - anabólicas (que é a síntese, ou seja, formação de compostos). As vias catabólicas são acompanhadas por liberação de energia livre, enquanto o anabolismo requer energia para ser realizado. Vias metabólicas •Vias catabólicas: convergentes •Vias anabólicas: divergentes •Algumas vias são cíclicas, ou seja, um precursor da via é regenerado por meio de uma série de reações. Características das rotas metabólicas: - Irreversibilidade - Direcionamento - Economia dos intermediários - Regulação DG’°<0 A 2 1 C B ciclo fútil Características das rotas metabólicas: - Irreversibilidade - Direcionamento - Economia dos intermediários - Regulação Várias etapas existem para oxidar a glicose más somente uma faz sentido em determinado momento para preencher as necesidadesa célula Características das rotas metabólicas: - Irreversibilidade - Direcionamento - Economia dos intermediários - Regulação Intermédiários que participam de forma reversível nas reções de oxido-redução como transportadores de életrons Coenzimas como transportadores de elétrons Reações de oxidação-redução: Agente redutor: molécula doadora de elétrons Agente oxidante: molécula receptora de elétrons C6H12O6 + 6O2 NAD+/FAD 6CO2 + 6H2O NADH/FADH2 Os nucleotídeos NAD+, NADP+, FMN e FAD são coenzimas hidrossolúveis que sofrem oxidações e reduções reversíveis em muitas das reações metabólicas de transferência de elétrons. NADH FADH2 ATP = outro intermediário Cineticamente estável e termodinacamente instável Acoplamento de energia reações exergônicas (espontâneas) X reações endergônicas DG’° para oxidação completa da glicose em CO2 + H20 ~ 686 kcal/mol (2850 kJ/mol) DG’° de hidrolíse de ATP ~7,3 kcal/mol (30,5 kJ/mol) Acoplamento das reações permite a síntese de várias moléculas de ATP Características das rotas metabólicas: - Irreversibilidade - Direcionamento - Economia dos intermediários - Regulação • Limitado pelo substrato (reação em equilíbrio). • Limitado pela enzima (reação exergônica) – passo limitante da via. • Enzimas específicas (pelo menos uma) para catalisar apenas anabolismo ou catabolismo. As 3 etapas da respiração celular ATP ADP + H+ NADH + H+ ADP NAD+ ATP H2O ATP ADP + H+ NADH + H+ ADP NAD+ + Pi ATP
Download