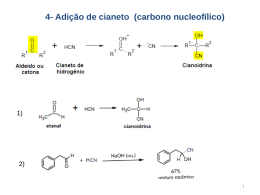
Alcenos e Alcinos: síntese e reatividade Introdução à Química Orgânica Síntese Reações de eliminação • Desidroalogenação – Reação E2 • Favorecimento: haletos secundários ou terciários, base volumosa para haletos primários, base forte não polarizável, temperatura elevada – Regra de Zaitsev • Com base pequena, o alcenos mais substituído é formado preferencialmente Explicação para a regra de Zaitsev • Estado de transição é parecido com o produto • Energia do estado de transição é menor quanto mais estável o alceno com o qual aparenta • A velocidade de formação de produto que passa pelo estado de transição de menor energia é maior Formação do alceno menor substituído • Base volumosa (terc-butóxido, por exemplo) • O hidrogênio “interno” está menos acessível • Quando isso ocorre, dizemos que foi seguida a regra de Hoffman • Ex.: 2-bromo-2-metil-buteno produzindo 2metil-2-buteno (t-BuOK em t-BuOH) Desidratação de alcoóis • Os alcoóis perdem uma molécula de água em ácido concentrado, formando um alceno • Isso ocorre principalmente por um mecanismo do tipo E1, para os álcoóis secundários e terciários. (E2 para primários) • Os alcoóis terciários sofrem desidratação mais facilmente (condições mais brandas) Mecanismo para a Reação Rearranjos • É muito comum que os produtos da desidratação de alcoóis sejam fruto de rearranjos da cadeia. Ex.: Explicação para os rearranjos • Os carbocátions tendem a apresentar movimentação de grupos (H- e CH3-), de um carbono para outro, para formar outros carbocátions mais estáveis • A perda posterior de H+ leva a alcenos com cadeias carbônicas rearranjadas Reatividade Alcinos • Acidez de alcinos terminais (reação com amideto) • Produção de alcinos por meio de eliminação de vic-dialetos • Substituição de hidrogênio acetilênicos Hidrogenação • Importância • Participação do catalisador na hidrogenação de alcenos • Adições sin e anti • Hidrogenação de alcinos: produção de alcenos cis e trans Reações de adição em alcenos e alcinos • A dupla ligação é reativa, principalmente devido à alta densidade eletrônica em seu entorno (adição eletrofílica) • Diversos compostos se adicionam à dupla, tanto aqueles simétricos (X2, por exemplo) como assimétricos (HX e outros) Adição de haletos de hidrogênio a alcenos • Qual o produto da adição de ácido bromídico ao propeno? • Mecanismo • Regra de Markovinikov • Exceção • Estereoquímica • Adição de água e rearranjos • Oximercuração Regra de Markovnikov • Transcrição: – Na adição iônica de um reagente assimétricoa uma ligação dupla, a parte positiva do reagente de adição se liga ao átomo de carbono da ligação dupla de modo a produzir o carbocátion mais estável como intermediário. Adições anti-Markovnikov • Hidroboração/hidrólise-oxidação – A hidroxila é adicionada no carbono menos substituído – A adição é estereoespecífica (sin) Adição eletrofílica de bromo e cloro à dupla • Adição de cloro ao eteno e geração de cloreto de vinila por E2 • Adição é anti • “descoloração da solução bromo” Reação de alcenos com bromo Mecanismo da reação com bromo Mecanismo da reação com bromo Estereoespecificidade Oxidação de alcenos • Di-hidroxilação sin – Tetróxido de ósmio • Quebra oxidativa – Permanganato de potássio em meio básico • Alcenos mono e dissubstituídos: ácidos ou cetonas + CO2 – Ozonólise • Aldeídos/cetonas
Download