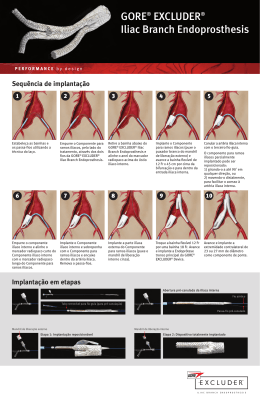
TREINAMENTO CLÍNICO PERFORMANCE through collaboration IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Design do dispositivo • A GORE® EXCLUDER® Iliac Branch Endoprosthesis foi projetada como um dispositivo de perfil baixo simples e fácil de usar, que oferece o tratamento endovascular de aneurismas da artéria ilíaca comum ou de aneurismas aortoiliacos. • A GORE® EXCLUDER® Iliac Branch Endoprosthesis deve ser usada em conjunto com a GORE® EXCLUDER® AAA Endoprosthesis e não foi concebida para ser usada isoladamente. • A GORE® EXCLUDER® Iliac Branch Endoprosthesis é baseada no design da GORE® EXCLUDER® AAA Endoprosthesis. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Indicações de uso Componentes para ramos ilíacos e ilíaca interna A GORE® EXCLUDER® Iliac Branch Endoprosthesis (IBE) foi concebida para isolar a artéria ilíaca comum do fluxo sanguíneo sistêmico e preservar o fluxo sanguíneo nas artérias ilíacas interna e externa em pacientes com um aneurisma na ilíaca comum ou aortoiliacos, e que tenham a anatomia apropriada, inclusive: 1. A cesso ilíaco/femoral adequado 2. D iâmetro mínimo da ilíaca comum de 17 mm na zona de implantação proximal da IBE 3. I ntervalo de diâmetro de tratamento da artéria ilíaca externa de 6,5 a 25 mm e comprimento da zona de selamento de pelo menos 10 mm 4. I ntervalo de diâmetro de tratamento da artéria ilíaca interna de 6,5 a 13,5 mm e comprimento da zona de selamento de pelo menos 10 mm A GORE® EXCLUDER® Iliac Branch Endoprosthesis é contraindicada em: • P acientes com sensibilidade ou alergias conhecidas aos materiais do dispositivo. acientes com infecção sistêmica que possam correr risco maior de infecção das • P próteses endovasculares. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Demonstração do produto IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS apresentação e descrição do produto IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Design modular • GORE® EXCLUDER® Iliac Branch Endoprosthesis —— Componente para ramos ilíacos —— Componente para ilíaca interna • Usada em conjunto com a GORE® EXCLUDER® AAA Endoprosthesis* —— Tronco e extremidade ipsilateral da endoprótese —— Endoprótese de extremidade contralateral —— Extensão ilíaca —— Extensão aórtica * Consulte as Instruções de uso (IFU) da GORE® EXCLUDER® AAA Endoprosthesis. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Recursos Componente para ramos ilíacos • • • • • • Design de stent sinusoide inovador e totalmente compatível Superfície luminal de ePTFE biocompatível e durável Conexão sem sutura entre a prótese e o stent Componente para ramos ilíacos Implantação de perfil baixo Abertura pré-canulada da ilíaca interna Amplo intervalo de tratamento da artéria ilíaca externa • Reposicionável —— Inserção do GORE® SIM-PULL Delivery System em duas etapas Componente para ilíaca interna • • • • • • Design de stent sinusoide inovador e totalmente compatível Componente Superfície luminal de ePTFE biocompatível e durável para ilíaca interna Conexão sem sutura entre a prótese e o stent Implantação de perfil baixo Amplo intervalo de tratamento da artéria ilíaca interna Implantação hub-to-tip IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Componente para ramos ilíacos • Diâmetro proximal de 23 mm 10 cm • Diâmetro da extremidade distal de 10/12/14,5 mm • Bainha introdutora de 16 Fr —— DE = 6,2 mm • Comprimento: 10 cm • Comprimento até a perna contralateral: 5,5 cm • Comprimento de trabalho do catéter de 61 cm 10, 12, 14,5 mm 23 mm Marcador radiopaco (curto) da ilíaca externa Marcadores radiopacos (2 curtos) Anel marcador radiopaco 13 mm Marcador radiopaco (longo) da ilíaca interna 3 cm Marcador radiopaco 2,5 cm IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Componente para ilíaca interna • Diâmetros distais: 10/12/14,5 mm 7 cm • Bainha introdutora reforçada, flexível de 12 Fr x 45 cm —— DE = 5,0 mm • Comprimento: 7 cm 10, 12, 14,5 mm 16 mm • Comprimento de trabalho do catéter de 63 cm • Implantação hub-to-tip Distal 7 cm Marcadores radiopacos (2) IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. Proximal BRANC H END O PRO STHESIS Endopróteses de extremidades contralaterais como componentes de ligação • Determinado pelo diâmetro da zona de fixação proximal do componente para ramos ilíacos —— 17 a 21,5 mm = 23 mm Endoprótese de extremidade contralateral —— > 21,5 mm = 27 mm Endoprótese de extremidade contralateral 3 cm 3 cm 27 mm 23 mm 2,5 cm 2,5 cm IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS GORE® SIM-PULL Delivery Catheter Hub Porta de lavagem Número de lote/ rótulo de tamanho do dispositivo Válvula Tuohy-Borst/ lúmen do fio-guia Mandril de liberação O GORE® SIM-PULL Delivery Catheter Hub está disponível em todos* os dispositivos, com exceção do tronco e extremidades ipsilaterais de 31 mm e 35 mm. * Não mais disponível na Europa no tronco e extremidades ipsilaterais. O GORE® SIM-PULL Delivery Catheter Hub foi alterada para o GORE® C3® Delivery System. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Catéter de implantação da GORE® EXCLUDER® Iliac Branch Endoprosthesis • Semelhante ao design do GORE® SIM-PULL Delivery System • Implantação em etapas do Componente para ramos ilíacos Mandril de liberação externo Mandril de liberação interno IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação em etapas • Abertura pré-canulada da ilíaca interna • Etapa 1: Implantação reposicionável • Etapa 2: Dispositivo totalmente implantado IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS considerações anatômicas – medições relacionadas ao dispositivo IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Modalidades de exames por imagem • TC, ATC (espiral) com Reconstrução multiplanar (RMP) volumétrica ou renderização 3D. • Angiografia com catéter marcador operatório para verificar os comprimentos de tratamento. • RM de alta resolução/RMP (opção sem contraste). • As recomendações de exames de imagem pré e pós-operatórios são descritas nas Instruções de uso (IFU) da GORE® EXCLUDER® Iliac Branch Endoprosthesis. • Consulte as Instruções de uso (IFU) da GORE® EXCLUDER® AAA Endoprosthesis. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diretrizes de medição recomendadas pela Gore • Utilize as ferramentas de medição (calibradores ou computador PACS) para obter uma medição precisa. NÃO faça uma estimativa. • Para a seleção do dispositivo, mantenha as seguintes especificações de sobredimensionamento: —— 7 a 35% para as artérias ilíacas interna e externa. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diretrizes de medição de diâmetro da Gore • A GORE® EXCLUDER® Iliac Branch Endoprosthesis exige medições de parede interna a parede interna do vaso desejado para dimensionar adequadamente as próteses. 28 mm 28 mm 28 mm 30,5 mm 32 mm 33,4 mm Por exemplo: “Diferença média de diâmetro do colo aórtico entre as medições do diâmetro interno e externo 3,83 mm (Desvio padrão [DP], 1,12 mm; P<0,001)” M. Mehta, “As medições de diâmetro do colo aórtico para EVAR são específicas para os dispositivos; implicações de medições da parede do colo aórtico proximal íntima-para-íntima do dimensionamento de stents GORE® EXCLUDER®.” Endovascular Today Supplement, January 2009. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diâmetro na zona de implantação proximal • O diâmetro mínimo do vaso na zona de implantação proximal da IBE deve ser ≥ 17 mm. • Medir (na TC) somente fluxo na luz do vaso. NÃO incluir irregularidades da parede (inclusive trombo e calcificação). TC axial da artéria ilíaca comum proximal Linha central da artéria ilíaca comum IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diâmetro da bifurcação da ilíaca • O diâmetro mínimo do vaso na zona de implantação proximal da IBE deve ser ≥ 17 mm. • O diâmetro mínimo da bifurcação da ilíaca recomendado deve ser ≥ 14 mm. • Medir (na TC) somente fluxo na luz do vaso. NÃO incluir irregularidades da parede (inclusive trombo e calcificação). TC axial da bifurcação da ilíaca comum proximal Linha central da artéria ilíaca comum IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diâmetro do colo aórtico distal • A Gore recomenda que o diâmetro do fluxo na luz do vaso do colo distal deve ser ≥ 18 mm para acomodar ambas as extremidades da GORE® EXCLUDER® AAA Endoprosthesis. • Se a GORE® EXCLUDER® Iliac Branch Endoprosthesis se estender na ou acima da bifurcação aórtica, a Gore recomenda que o fluxo na luz do vaso do colo distal seja ≥ 23 mm. Se o diâmetro do fluxo na luz do vaso do colo distal for menor do que os valores recomendados sob estas condições, isso pode levar a uma possível competição entre membros adjacentes, compressão focal ou deficiência de fluxo. TC do colo distal IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Diâmetro da bifurcação da ilíaca • Se a GORE® EXCLUDER® Iliac Branch Endoprosthesis se estender acima da bifurcação aórtica, a Gore recomenda que o fluxo na luz do vaso do colo distal seja ≥ 23 mm. Colo aórtico distal Bifurcação aórtica IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Comprimento mínimo do lado do tratamento do ramo ilíaco contralateral • Determine os comprimentos com TC/RM ou RMP calibrada. • Verifique todos os comprimentos com o catéter marcador usando angiografia. • A anatomia do paciente deve ser suficiente para acomodar todos os dispositivos. A tabela a seguir aponta o comprimento mínimo recomendado da renal mais inferior até a bifurcação ilíaca para o lado do tratamento com a extremidade contralateral da GORE® EXCLUDER® Iliac Branch Endoprosthesis. Diâmetro proximal (mm) da Endoprótese com tronco e extremidade ipsilateral Comprimento mínimo necessário da renal-até-ilíaca interna (cm) 23, 26, 28,5 16,5 31 17,5 35 18,5 IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Comprimento mínimo da renal-atéhipogástrica • A seção proximal da Endoprótese com tronco e extremidade ipsilateral tem um comprimento fixo de 4 cm (5 cm para tronco de 31 mm; 6 cm para tronco de 35 mm). 4 (5, 6) cm • O menor comprimento da Endoprótese com extremidade contralateral de 23 mm e 27 mm é de 10 cm. • A abertura da ilíaca interna do Componente para ramos ilíacos tem um comprimento fixo de 2,5 cm. 10 cm • Comprimento mínimo da renal-até-hipogástrica: —— 4 cm (5 cm ou 6 cm para dispositivos de 31 mm e 35 mm, respectivamente) (Comprimento fixo do tronco proximal) 2,5 cm —— + 10 cm (Extremidade contralateral mais curta) —— + 2,5 cm (Comprimento fixo da abertura da ilíaca interna do Componente para ramos ilíacos) —— = 16,5 cm (17,5 cm ou 18,5 cm para dispositivos de 31 mm e 35 mm, respectivamente) IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Aneurismas bilaterais da ilíaca comum • O tratamento bilateral com o dispositivo (apenas UE) é possível com um planejamento de caso cuidadoso • O comprimento mínimo para o lado do tratamento do ramo ilíaco ipsilateral —— Comprimentos mínimos necessários da renal-até-ilíaca interna listados por dispositivo: Diâmetro proximal (mm) da Endoprótese com tronco e extremidade ipsilateral Extremidade contralateral de 23 mm1 Comprimento mínimo necessário da renal-até-ilíaca interna (cm) Extremidade contralateral de 27 mm2 Comprimento mínimo necessário da renal-até-ilíaca interna (cm) 23, 26, 28,5 19,5 20,5 31 20,5 21,5 35 21,5 22,5 —— Quando a GORE® EXCLUDER® Iliac Branch Endoprosthesis estiver tratando o lado ipsilateral, utilize o corpo principal e extremidade contralateral de menor comprimento disponível. Confirme a sobreposição de pelo menos 3 cm entre os componentes. A extensão mínima da extremidade contralateral de 23 mm é de 5 cm devido à zona cônica distal. A extensão mínima da extremidade contralateral de 27 mm é de 6 cm devido à zona cônica distal. 1 2 IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Comprimento mínimo da extensão ipsilateral • O comprimento do tronco e extremidade ipsilateral é de no mínimo 12 cm, 13 cm, 14 cm, dependendo do diâmetro proximal. • Os menores comprimentos em que os dispositivos de 23 mm e 27 mm podem se estender a partir da extremidade ipsilateral são de 5 e 6 cm, respectivamente. 12 (13, 14) cm • A abertura da ilíaca interna do Componente para ramos ilíacos tem um comprimento fixo de 2,5 cm. • Comprimento mínimo da renal-até-hipogástrica: —— 12 cm (13 cm ou 14 cm para dispositivos de 31 mm e 35 mm, respectivamente) 5, 6 cm 2,5 cm —— + 5 cm ou 6 cm (menor extensão dos dispositivos de ligação de 23 mm e 27 mm, respectivamente) —— + 2,5 cm (Comprimento fixo da abertura da ilíaca interna do Componente para ramos ilíacos) —— = 19,5 cm (mais curto) a 22,5 cm (mais longo) IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Comprimento da ilíaca comum • Um comprimento da artéria ilíaca comum inferior a 5,5 cm indica que a porção proximal da GORE® EXCLUDER® Iliac Branch Endoprosthesis ficará acima da bifurcação aórtica. —— Avalie se o diâmetro do colo aórtico distal é ≥ 23 mm. 10 cm —— A ausência de AAA, juntamente com ilíacas comuns curtas, pode dificultar a colocação da bainha “up-and-over”. 10, 12, 14,5 mm 23 mm Marcador radiopaco (curto) da ilíaca externa Marcadores radiopacos (2 curtos) Anel marcador radiopaco 13 mm Marcador radiopaco (longo) da ilíaca interna 3 cm 2,5 cm Marcador radiopaco IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Considerações sobre a artéria ilíaca externa • Dimensionamento —— Exige diâmetro de tratamento da artéria ilíaca externa de 6,5 mm a 25 mm. —— Exige um comprimento da zona de selamento acumulativo, não contínuo, de ≥ 10 mm. —— Utilize TC/RM para medir o diâmetro e RMP para estimar o comprimento. • Outros fatores —— Tortuosidade, trombos e calcificação são fatores que podem afetar o selamento e a patência. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Considerações sobre a artéria ilíaca interna • Dimensionamento —— Exige diâmetro de tratamento da artéria ilíaca interna de 6,5 mm a 13,5 mm. —— Exige um comprimento da zona de selamento acumulativo, não contínuo, de ≥ 10 mm. —— O Componente para ilíaca interna se sobrepõe ~2,5 cm à abertura da GORE® EXCLUDER® Iliac Branch Endoprosthesis. —— Utilize TC/RM para medir o diâmetro e RMP para estimar o comprimento. • Outros fatores —— Tortuosidade, trombos e calcificação são fatores que podem afetar o selamento e a patência. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Formulário de planejamento de caso IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Formulário de planejamento de caso — Aneurisma bilateral da ilíaca comum Device Selection Patient Confidential Information ILIAC BRANCH ENDOPROSTHESIS BILATERAL MEASUREMENT FORM I L I AC BR A NCH E NDO PR O STHE S I S The following information is required to ensure that the appropriate devices and backups are available for the procedure. Patient ID: Patient Confidential Information The following information is required to ensure that the appropriate devices and backups are available for the procedure. Institution: Patient ID: Reviewer: Sizing Guide Date of CT / CTA: Signature (Date): Trunk-Ipsilateral Leg Endoprosthesis: Trunk-Ipsilateral Iliac Branch Endoprosthesis side: Right Left d a. Aortic Diameter at proximal implantation site b. Aortic Diameter—15 mm distal to proximal implantation site c. Aortic Neck Length (≥15mm) d. Proximal Neck Angle (< 60˚) e. Maximal Aortic Diameter f. Length from lowest renal to native aortic bifurcation g. Distal aortic neck diameter h. Length from lowest renal to internal iliac artery i. Length from the aortic bifurcation to internal iliac artery j. Minimal vessel diameter within IBE proximal implantation zone** k. Common iliac artery diameter at iliac bifurcation** l. Maximum common iliac artery diameter m. External iliac artery intended treatment diameter (Range) n. External iliac artery seal length ≥ 10 mm? o. Internal iliac artery intended treatment diameter (Range) p. Internal iliac artery seal length ≥ 10mm? q. Access vessel diameter range Yes No c f e No Yes No Contra Bridge Calculation: Length from lowest renal to internal iliac artery s. Length from the aortic bifurcation to internal iliac artery t. Minimal vessel diameter within IBE proximal implantation zone.** u. Common iliac artery diameter at iliac bifurcation** v. Maximum common iliac artery diameter w. External iliac artery intended treatment diameter (Range) x. External iliac artery seal length ≥ 10mm? y. Internal iliac artery intended treatment diameter (Range) z. Internal iliac artery seal length ≥ 10mm? Diameter— Iliac End (mm) 12 / 14.5 12 / 14.5 12 / 14.5 14.5 14.5 Renal to Internal – __________(cm) – Diameter— Iliac End (mm) Iliac Branch Component Length (cm) 6.5–9 10 10 10–11 12 10 12–13.5 14.5 10 Intended External Iliac Vessel Diameter (mm) Internal Iliac Components: Intended Internal Iliac Vessel Diameter (mm) 6.5–9 Diameter— Iliac End (mm) 10 IIC Length (cm) 7 10–11 12 7 12–13.5 14.5 7 Proximal Trunk Length – Iliac Branch Component Gate Length 4 / 5 / 6 (cm) – 2.5 cm GORE® C3® Delivery System GORE® C3® Delivery System 23, 26, 28.5 mm / 31 mm / 35 mm Intended Trunk-Ipsilateral Leg Endoprosthesis: (circle one) Lowest renal: Left Right Same Are any landing zones dissected, heavily calcified, or heavily thrombosed? Yes No Yes No Thrombus in seal zone? (Iliac Branch Endoprosthesis side) No External Iliac Internal Iliac Yes No Calcification in seal zone? (Iliac Branch Endoprosthesis side) No External Iliac Internal Iliac GORE® C3® Delivery System = Intended Contra Bridge = ________(cm) Qty Qty Qty Contralateral Leg Endoprosthesis*: Qty Qty Catalogue Number Qty Catalogue Number Qty Catalogue Number RLT231212 RLT261212 RLT281212 RLT311413 RLT231214 RLT261214 RLT281214 RLT311415 PXC121200 PLC181000 PLC231400 RLT231216 RLT261216 RLT281216 RLT311417 PXC121400 PLC181200 PLC271000 RLT231218 RLT261218 RLT281218 RLT351414 PXC141000 PLC181400 PLC271200 RLT231412 RLT261412 RLT281412 RLT351416 PXC141200 PLC201000 PLC271400 RLT231414 RLT261414 RLT281414 RLT351418 PXC141400 PLC201200 RLT231416 RLT261416 RLT281416 PLC161000 PLC201400 RLT231418 RLT261418 RLT281418 PLC161200 PLC231000 Intended Iliac Branch Component: Qty GORE® C3® Delivery System Catalogue Number Intended Internal Iliac Component: Qty Catalogue Number PXC121000 Intended Contralateral Leg Endoprosthesis (for bridging TrunkIpsilateral to Iliac Branch Component)*: Qty Catalogue Number Qty Catalogue Number CEB231010C HGB161007C CEB231210C HGB161207C PLC231000 PLC271000 CEB231410C HGB161407C PLC231200 PLC271200 PLC231400 PLC271400 Aortic Extender**: (See Reverse for Device Selection Form) Intended Iliac Vessel Diameter (mm) 10–11 / 12–13.5 10–11 / 12–13.5 10–11 / 12–13.5 12–13.5 12–13.5 Order Form Qty Left Iliac Branch Component: Lengths (cm) 12 / 14 / 16 / 18 12 / 14 / 16 / 18 12 / 14 / 16 / 18 13 / 15 / 17 14 / 16 /18 Total Iliac Branch Total Iliac Branch Total Iliac Branch Endoprosthesis-side Endoprosthesis-side Endoprosthesis-side Intended Length when Length when Iliac Vessel Diameter— Contralateral Length when inserted inserted in 35 mm inserted in 31 mm in 23, 26, 28.5 mm Leg Lengths Iliac End Diameter Trunks (cm) Trunks (cm) Trunks (cm) (cm) (mm) (mm) 17–21.5 23 10 / 12 / 14 16.5 / 18.5 / 20.5 17.5 / 19.5 / 21.5 18.5 / 20.5 / 22.5 > 21.5 27 10 / 12 / 14 16.5 / 18.5 / 20.5 17.5 / 19.5 / 21.5 18.5 / 20.5 / 22.5 g Yes Diameter— Aortic End (mm) 23 26 28.5 31 35 Contralateral Leg Endoprosthesis*: a r. NOTES: AS0905EN1 b Contralateral Iliac Branch Endoprosthesis side: Right aa. Access vessel diameter range (circle one) Intended Aortic Inner Diameter (mm) 19–21 22–23 24–26 27–29 30–32 Iliac Extender: Endoprosthesis Length (cm) Proximal Extension (cm) 3.3 0–1.6 PLA260300 3.3 0–1.6 PLA280300 3.3 0–1.6 PXL161007 8–9 10 PLA320400 4.5 0–2.2 PXL161207 10–11 12 PLA360400 4.5 0–2.2 PXL161407 12–13.5 14.5 Qty Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. * For use of Contralateral Leg Endoprosthesis as an Iliac Extender, please see GORE Intended Iliac Inner Diameter (mm) Endoprosthesis Diameter (mm) EXCLUDER® AAA Endoprosthesis Measurement / Device Selection Form: www.goremedical.com/excluder/caseprep/ ** Recommended prosthesis oversizing relative to the aorta is approximately 10–21%. Proximal extension length range: 0–2.2 cm. ® PLC231200 GORE DrySeal Sheath with Hydrophilic Coating: (outer diameter) ® Sheath Size Qty Catalogue Number 12 Fr (5 mm) DSL1228 14 Fr (5.5 mm) DSL1428 16 Fr (6.2 mm) DSL1628 18 Fr (6.8 mm) DSL1828 Case planning / procedural notes / comments: Catalogue Number PLA230300 Catalogue Number PLC161400 ______________________________ ______________________________ ______________________________ ______________________________ ______________________________ ______________________________ Dispositivos auxiliares recomendados1, 3, 4 Item Fio-guia “ultrarrígido” de 0,035", x 2 fios (obrigatório) Fio-guia flexível de 0,035" Bainha introdutora de 16 Fr da Gore Bainha introdutora de 18 Fr da Gore Bainha reforçada, flexível de 12 Fr x 45 cm Balão ATP de 14 mm2 Exemplo Fio-guia AMPLATZ SUPER STIFF da Boston Scientific Corporation de 0,035" x 180 cm x ponta de 3 cm 0,035" x 180 cm x ponta de 6 cm Fio-guia GLIDEWIRE padrão da Terumo Interventional Systems 0,035" x 180 cm x ponta de 3 cm GORE® DrySeal Sheath with Hydrophilic Coating (DSL1628) GORE® DrySeal Sheath with Hydrophilic Coating (DSL1828) Qualquer fornecedor Qualquer fornecedor; fio-guia de 0,035" compatível; comprimento do balão 4 cm, comprimento de trabalho 75 cm2 Qualquer fornecedor; 5 Fr/80 cm/0,035" Catéteres angiográficos seletivos para acesso do fio-guia à artéria ilíaca interna e orifício da extremidade contralateral Catéter marcador Qualquer fornecedor; marcador duplo de 5 Fr, 21 cm 2, 4 É necessário um balão de moldagem ou oclusão aórtica , por exemplo: Balão de moldagem de 16 a 34 mm GORE® Tri-Lobe Balloon Catheter (pequeno — BCM1634) Balão de oclusão de 65, 100 cm Catéter-balão para stent Q50® PLUS (Q50-65P ou Q50-100P) 2 Catéter-balão EQUALIZER da Boston Scientific Corporation, Balão de oclusão de 27, 33 mm comprimento de trabalho de 65 ou 100 cm2 Verifique a compatibilidade de todos os balões e bainhas com o GORE® EXCLUDER® Device antes do uso procedimental inicial. 2 Aviso: Monitore atentamente os volumes e pressões dos balões conforme recomendação nas Instruções de uso do catéter-balão fornecidas pelo fabricante. 3 A identificação de um dispositivo auxiliar não constitui aprovação desse dispositivo ou de seu fabricante. 4 Os produtos de outros fabricantes em configurações semelhantes podem ser compatíveis; verifique com o representante do fabricante, bem como com seu Representante de vendas da Gore. 1 Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. IL IAC BRANC H END O PRO STHESIS Dispositivos auxiliares recomendados1, 3, 4 Item Balão ATP de 14 mm Balão ATP de 12 mm2 Balão ATP de 10 mm2 Fio-guia de 0,035", angulado para o orifício de acesso da extremidade contralateral Fio-guia ultrarrígido de 0,035" com comprimento de troca 2 Kits de catéter-laço Balão de diâmetro grande ou stents autoexpansíveis por todo o intervalo de diâmetros correspondentes ao GORE® EXCLUDER® Device Dispositivos para fechamento percutâneo Molas de embolização Exemplo Qualquer fornecedor; fio-guia de 0,035" compatível; comprimento do balão 4 cm, comprimento de trabalho 75 cm3 Qualquer fornecedor; 0,035" x 180 cm Qualquer fornecedor; 0,035" x 260 cm Qualquer fornecedor; 6 Fr/102 cm/diâmetro de 15, 20, 25, 30, 35 mm Qualquer fornecedor Qualquer fornecedor; 8 Fr e 10 Fr Qualquer fornecedor Verifique a compatibilidade de todos os balões e bainhas com o GORE® EXCLUDER® Device antes do uso procedimental inicial. Aviso: Monitore atentamente os volumes e pressões dos balões conforme recomendação nas Instruções de uso do catéter-balão fornecidas pelo fabricante. 3 A identificação de um dispositivo auxiliar não constitui aprovação desse dispositivo ou de seu fabricante. 4 Os produtos de outros fabricantes em configurações semelhantes podem ser compatíveis; verifique com o representante do fabricante, bem como com seu Representante de vendas da Gore. 1 2 IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS sequência procedimental/ método de implantação IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Acesso bilateral • Seguindo os procedimentos padrão, realize o acesso percutâneo e/ou exposição cirúrgica para obter acesso ao vaso. • Utilize a visualização fluoroscópica para todas as manipulações de fio-guia, bainha e catéter do dispositivo. • Estabeleça o acesso bifemoral através do procedimento padrão. • Introduza as bainhas adequadas e posicione-as próximo à bifurcação aórtica. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Bainha flexível • Bainha reforçada, flexível, de 12 Fr x 45 cm • Bainha DrySeal de 16 Fr com revestimento hidrofílico da GORE® —— Acomoda vários fios-guia IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Estabeleça o fio-guia e o fio-guia transversal Coloque dois fios-guia no lado do tratamento do ramo ilíaco: • Um fio aórtico de 0,035" (0,89 mm) ultrarrígido ou fio-guia equivalente • Um fio-guia transversal flexível, de 0,035", voltado para cima e sobre a bifurcação aórtica, alcançado através da técnica do laço IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Prepare a ligação do componente para ramos ilíacos usando o tubo removível do fio-guia (RGT) Fio-guia transversal Fio-guia transversal Tubo removível do fio-guia Fio aórtico Fio aórtico Fio-guia transversal Fio aórtico Fio aórtico IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Posicione o Componente para ramos ilíacos • Acompanhe o Componente para ramos ilíacos através da bainha introdutora sobre ambos os fios-guia para se aproximar da posição desejada. Advertências: Não avance nenhum dispositivo para fora da bainha. Não gire nenhum dispositivo enquanto a endoprótese estiver dentro da bainha introdutora. Caso sinta resistência, pare de avançar e avalie a causa da resistência. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Posicione o Componente para ramos ilíacos • Retire com cuidado a bainha introdutora do lado do tratamento do ramo ilíaco. Verifique visualmente se a extremidade dianteira da bainha introdutora não está cobrindo a endoprótese. • Reposicione e gire o Componente para ramos ilíacos conforme necessário para posicionar adequadamente o dispositivo. Posicione o anel radiopaco proximal à artéria ilíaca interna, e o marcador radiopaco longo orientado na direção da artéria ilíaca interna. Anel radiopaco Marcador radiopaco longo IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação parcial do Componente para ramos ilíacos • Estabilize o catéter e a bainha. A implantação pode ser feita por duas pessoas. • Solte o mandril de liberação externo branco, puxe o mandril diretamente para fora do conector em Y no hub do catéter em um movimento uniforme contínuo. A B Advertência: O Cdispositivo está parcialmente implantado, não tente remover o catéter de implantação. Não solte nem remova o mandril de liberação interno cinza. Opcional: O componente para ramos ilíacos parcialmente implantado pode ser reposicionado 1) girando-o a até 90˚ em qualquer direção, ou 2) movendo-o distalmente, para facilitar o acesso à artéria ilíaca interna. Advertência: O reposicionamento excessivo pode resultar em dano ao tecido e/ou deslocamento do trombo. O reposicionamento em uma direção proximal não é recomendado. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação em etapas IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Bainha flexível Bainha flexível • Insira a bainha contralateral e o dilatador sobre o fio-guia transversal através do orifício da extremidade da ilíaca interna. • Remova o dilatador da bainha flexível. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Bainha flexível IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Canulação da ilíaca interna Otimize o ângulo do arco cirúrgico: • Otimize o ângulo do arco cirúrgico para a visualização angiográfica da ilíaca interna, melhorando assim a canulação da ilíaca interna. Canulação da artéria ilíaca interna: • Utilizando um terceiro fio, canule a artéria ilíaca interna com um fio-guia contralateral. —— O catéter angiográfico pode ser usado para facilitar a canulação. Observação: Recomenda-se manter o fio-guia transversal através da implantação do Componente para ilíaca interna para ajudar na estabilidade da bainha. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Posicione o Componente para ilíaca interna • Avance o componente para ilíaca interna com o fio-guia contralateral através do terceiro fio para dentro da artéria ilíaca interna. • Retire a bainha introdutora e verifique visualmente se a extremidade dianteira da bainha introdutora não está cobrindo a endoprótese. • Alinhe o marcador radiopaco curto da extremidade anatomicamente proximal (traseira do catéter) do Componente para ilíaca interna com o marcador radiopaco longo no Componente para ramos ilíacos parcialmente implantado. 10 cm 10, 12, 14,5 mm 23 mm Marcador radiopaco (curto) da ilíaca externa 7 cm Marcadores radiopacos (2 curtos) Anel marcador radiopaco 13 mm Marcador radiopaco (longo) da ilíaca interna 3 cm 16 mm Distal 2,5 cm Marcador radiopaco 7 cm Marcadores radiopacos (2) 10, 12, 14,5 mm Proximal IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação do Componente para ilíaca interna • Confirme visualmente a posição final do dispositivo. • Estabilize o catéter e a bainha. A implantação pode ser feita por duas pessoas. • Solte o mandril de liberação e puxe o mandril diretamente para fora do conector em Y no hub do catéter em um movimento uniforme contínuo para implantar o Componente para ilíaca interna. • Retire o catéter de implantação. • Avance e infle um catéter-balão ATP de 14 mm para assentar o Componente para ilíaca interna dentro do Componente para ramos ilíacos. • Avance e infle um catéter-balão ATP de tamanho apropriado para assentar a extremidade distal do Componente para ilíaca interna dentro da artéria ilíaca interna. Consulte as Instruções de uso (IFU). • Remova o fio-guia transversal com cuidado. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Posicione e implante o Componente para ilíaca interna IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Balonamento ATP • Balonamento de sobreposição do componente —— Seguindo as Instruções de uso do fabricante, avance e infle um catéter-balão ATP de 14 mm para assentar a extremidade proximal da extremidade contralateral dentro da região de sobreposição do orifício da extremidade contralateral. Marcador radiopaco Diâmetro da extensão ilíaca distal (mm) Diâmetro do balão ATP (mm) 10 12 14,5 16 18 20 23 27 10 12 14 16 18 20 24 28 • Balonamento do componente distal —— Seguindo as Instruções de uso do fabricante, infle o balão ATP na extremidade distal da extremidade contralateral para assentar o dispositivo na artéria ilíaca. Marcador de eixo —— Remova o catéter-balão com orientação fluoroscópica. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação completa do Componente para ramos ilíacos • Estabilize o catéter e a bainha. • Solte o mandril de liberação interno cinza. Puxe o mandril diretamente para fora do conector em Y no canhão do catéter em um movimento uniforme contínuo para concluir a implantação do Componente para ramos ilíacos. • Avance e infle um catéter-balão ATP de tamanho apropriado para assentar a extremidade distal do Componente para ramos ilíacos dentro da artéria ilíaca externa. Consulte as Instruções de uso (IFU). IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação em etapas IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implantação do GORE® EXCLUDER® Device Consulte as Instruções de uso (IFU) da GORE® EXCLUDER® AAA Endoprosthesis para obter as diretrizes completas para seleção, implantação e procedimento de balonamento do dispositivo com tronco e extremidade ipsilateral. • Troque a bainha reforçada flexível de 12 Fr pela GORE® DrySeal Sheath com revestimento hidrofílico de 18 Fr (conforme recomendação) e avance até a aorta infrarrenal. • Avance e implante a Endoprótese com tronco e extremidade ipsilateral de acordo com as IFU da GORE® EXCLUDER® AAA Endoprosthesis. • Faça a canulação da abertura contralateral. Confirme a canulação e verifique visualmente o comprimento usando um catéter calibrado do marcador radiopaco longo no GORE® EXCLUDER® Device até o marcador radiopaco longo na GORE® EXCLUDER® Iliac Branch Endoprosthesis a fim de selecionar o comprimento adequado da extremidade contralateral como componente de ligação até o Componente para ramos ilíacos. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Implante o componente de ligação • Verifique visualmente se o marcador radiopaco proximal na Endoprótese com extremidade contralateral está alinhado com o marcador radiopaco longo do GORE® EXCLUDER® Device e se o marcador distal está proximal ao marcador radiopaco longo no Componente para ramos ilíacos. • Implante a Endoprótese com extremidade contralateral de acordo com as Instruções de uso (IFU) da GORE® EXCLUDER® AAA Endoprosthesis. • Avance e infle um catéter-balão ATP de tamanho apropriado para assentar as extremidades proximal e distal da Endoprótese com extremidade contralateral dentro do outro dispositivo. • Realize uma angiografia final e avalie a patência e a existência de endoleaks. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS procedimentos adjuntos IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Procedimentos adjuntos Dispositivo unilateral em aneurismas bilaterais da ilíaca comum —— Determinação do lado —— Mola/cobertura versus desramificação para o lado oposto à GORE® EXCLUDER® Iliac Branch Endoprosthesis IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS estudo clínico de ide nos eua IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Critérios de inclusão – Requisitos de AAA • O principal objetivo do estudo da GORE® EXCLUDER® Iliac Branch Endoprosthesis (IBE 12-04) é avaliar a segurança e eficácia da GORE® EXCLUDER® Iliac Branch Endoprosthesis para o tratamento de sujeitos com aneurismas da artéria ilíaca comum (CIAA) ou aneurismas da aortoilíaca (AIA). • Critérios de inclusão de AAA: 1. A ilíaca comum a ser tratada deve ter um diâmetro máximo ≥ 25 mm com ou sem aneurisma da aorta abdominal concomitante, além de: • Diâmetro mínimo ≥ 17 mm na zona de implantação proximal da IBE, conforme avaliado pelo fluxo na luz do vaso; cálcio excluído • Diâmetro ≥ 14 mm na bifurcação ilíaca, conforme avaliado pelo fluxo na luz do vaso; cálcio excluído 2. Anatomia adequada para receber o GORE® EXCLUDER® Device e a GORE® EXCLUDER® Iliac Branch Endoprosthesis, inclusive: • Acesso ilíaco/femoral adequado • Diâmetro do colo aórtico infrarrenal de 19 a 32 mm • Comprimento do colo aórtico infrarrenal ≥ 15 mm • Ângulo do colo aórtico ≤ 60˚ • Zona de selamento da artéria ilíaca de pelo menos 10 mm com intervalos de diâmetro de tratamento dos casos a seguir conforme avaliados pelo fluxo na luz do vaso e trombo, se presente; cálcio excluído: —— 6,5 a 13,5 mm para a artéria ilíaca interna no lado da GORE® EXCLUDER® Iliac Branch Endoprosthesis —— 6,5 a 25 mm para a artéria ilíaca externa no lado da GORE® EXCLUDER® Iliac Branch Endoprosthesis —— 8 a 25 mm para a artéria ilíaca no lado da Endoprótese para ramos ilíacos que não são da GORE® EXCLUDER® IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Critérios de inclusão – Anatômicos • Requisitos do GORE® EXCLUDER® Device “padrão” para o colo proximal: —— Ângulo ≤ 60˚ —— Comprimento ≥ 15 mm —— Diâmetro de 19 a 32 mm • Ilíaca comum —— Diâmetro na zona de implantação proximal da GORE® EXCLUDER® Iliac Branch Endoprosthesis ≥ 17 mm IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Aneurismas bilaterais da ilíaca comum – Estudo de IDE • As duas artérias ilíacas comuns não podem ser tratadas segundo as IFU atuais da GORE® EXCLUDER® Endoprosthesis sem cobrir uma artéria ilíaca interna. • Uma artéria ilíaca interna deve ser abordada antes do procedimento com a GORE® EXCLUDER® Iliac Branch Endoprosthesis —— Oclusão de mola/tampão (no mínimo 24 horas antes do procedimento com a GORE® EXCLUDER® Iliac Branch Endoprosthesis) —— Revascularização cirúrgica (no mínimo 30 dias antes do procedimento com a GORE® EXCLUDER® Iliac Branch Endoprosthesis) • Se ambos os lados puderem ser tratados com a GORE® EXCLUDER® Iliac Branch Endoprosthesis (atendendo a todos os critérios de inclusão/exclusão), as imagens serão revisadas por um comitê para recomendar o lado do tratamento com a GORE® EXCLUDER® Iliac Branch Endoprosthesis —— A decisão final do tratamento cabe ao médico que realiza o implante IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Acompanhamento do paciente e recomendações de exames de imagem • Acompanhamento mínimo anual para pacientes sem nenhum problema conhecido. • Exames de acompanhamento: 1, 6, 12 meses, e anualmente a partir de então. —— Aumente a frequência se houver suspeita de alterações ou problemas. • TC/ATC como modalidades de acompanhamento. • Ultrassom e RM/ARM podem ser utilizados (p. ex., pacientes com sensibilidade ou intolerância ao contraste). • Testes não clínicos demonstraram que a GORE® EXCLUDER® AAA Endoprosthesis é condicional para RM. Ela pode passar por uma varredura em segurança sob as seguintes condições: —— Campo magnético estático de 3 Tesla ou menos. —— Campo magnético com gradiente espacial mais elevado de 3000 Gauss/cm ou menos. —— Valor máximo da taxa de absorção específica (SAR) média calculada para o corpo inteiro exibida pelo escâner de 2,0 W/kg por 15 minutos de varredura. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Acompanhamento do paciente e recomendações de exames de imagem (continuação) • Recomenda-se uma vigilância de TC mais rigorosa para: —— Aneurismas com endofuga detectável —— Alargamento do aneurisma (≥ 5 mm) em relação à base de referência independentemente do status da endofuga • A vigilância volumétrica de AAA é altamente sensível a alterações do aneurisma ao longo do tempo. • Se houver alguma preocupação em relação à integridade do dispositivo (p. ex., torção, rupturas do fio do stent, migração relativa do componente), pode-se adquirir uma série de filmes de radiografia. Recomenda-se o estudo de radiografia de quatro visualizações no dispositivo para ver com precisão os componentes do fio da endoprótese: —— Supino-frontal (AP) —— Lateral cruzada da mesa —— 30° LPO —— 30° RPO • Os pacientes podem ser inseridos em um registro que possa oferecer um controle dos exames, dados e comparações do paciente. IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS Eventos Adversos • Caso ocorra um evento adverso com a GORE® EXCLUDER® AAA Endoprosthesis ou com a GORE® EXCLUDER® Iliac Branch Endoprosthesis, ele deve ser relatado aos Coordenadores de Vigilância de Produtos na Gore. • Se for apropriado, devolva a GORE® EXCLUDER® AAA Endoprosthesis e/ou a GORE® EXCLUDER® Iliac Branch Endoprosthesis à Flagstaff para análise. Envie-a em um kit de histologia. Entre em contato com a vigilância de produto pelo e-mail [email protected] ou pelo telefone 1.800.528.1866, ramal. 44922 IL IAC Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. BRANC H END O PRO STHESIS W. L. Gore & Associates, Inc. Flagstaff, AZ 86004 +65.67332882 (Asia Pacific) 00800.6334.4673 (Europe) 800.437.8181 (United States) 928.779.2771 (United States) INDICAÇÕES DE USO: Componentes para ramos ilíacos e ilíaca interna. A GORE® EXCLUDER® Iliac Branch Endoprosthesis (IBE) foi concebida para isolar a artéria ilíaca comum do fluxo sanguíneo sistêmico e preservar o fluxo sanguíneo nas artérias ilíacas interna e externa em pacientes com um aneurisma na ilíaca comum ou na aortoilíaca, e que tenham a anatomia apropriada, inclusive: Acesso ilíaco/femoral adequado; diâmetro mínimo da ilíaca comum de 17 mm na zona de implantação proximal da IBE; intervalo de diâmetro de tratamento da artéria ilíaca externa de 6,5 a 25 mm e comprimento da zona de selamento de pelo menos 10 mm; intervalo de diâmetro de tratamento da artéria ilíaca interna de 6,5 a 13,5 mm e comprimento da zona de selamento de pelo menos 10 mm. Componentes da endoprótese com tronco e extremidade ipsilateral e extremidade contralateral. As Endopróteses com tronco e extremidade ipsilateral e extremidade contralateral destinam-se a oferecer selamento proximal e fixação à GORE® EXCLUDER® Iliac Branch Endoprosthesis após a implantação da GORE® EXCLUDER® Iliac Branch Endoprosthesis. Para mais informações sobre as indicações de uso e a implantação dos Componentes da Endoprótese com tronco e extremidade ipsilateral e extremidade contralateral, consulte as Instruções de uso da GORE® EXCLUDER® AAA Endoprosthesis. Componentes da extensão aórtica da endoprótese e da extensão ilíaca da endoprótese. As Endopróteses com extensões aórtica e ilíaca podem ser usadas depois da implantação das GORE® EXCLUDER® Iliac Branch and AAA Endoprostheses. Estas extensões devem ser usadas quando se deseja comprimento adicional e/ou selamento para a remoção do aneurisma. Para mais informações sobre as indicações de uso e a implantação da extensão aórtica e da extensão ilíaca, consulte as Instruções de uso da GORE® EXCLUDER® AAA Endoprosthesis. CONTRAINDICAÇÕES: A GORE® EXCLUDER® Iliac Branch Endoprosthesis é contraindicada em: Pacientes com sensibilidade ou alergias conhecidas aos materiais do dispositivo e pacientes com uma infecção sistêmica que possam estar em risco maior de infecção em próteses endovasculares. Consulte as Instruções de Uso em goremedical.com para obter a descrição completa de todos os avisos, precauções e eventos adversos. Aviso: Dispositivo para pesquisa. Limitado pela lei dos Estados Unidos para uso em pesquisa. goremedical.com Os produtos listados podem não estar disponíveis em todos os mercados. AMPLATZ SUPER STIFF and EQUALIZER are trademarks of Boston Scientific Corporation or its affiliates. Q50® is a trademark of QXMédical, LLC. GLIDEWIRE is a trademark of Terumo Interventional Systems. GORE®, C3®, EXCLUDER®, PERFORMANCE THROUGH COLLABORATION, SIM-PULL, and designs are trademarks of W. L. Gore & Associates. © 2013–2015 W. L. Gore & Associates, Inc. AS1161-PT2 AUGUST 2015
Download