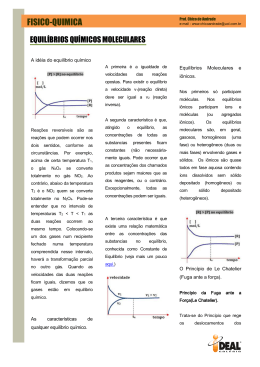
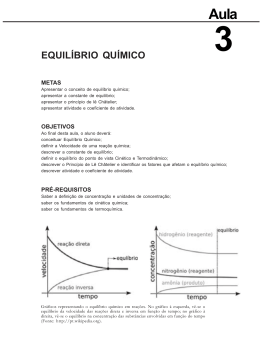
Alunos: André de Souza Almeida 14385 Beatriz Amaral Misson 14388 Temas Abordados no capítulo: • • • • • • • Conceito de equilíbrio O Processo de Haber A constante de equilíbrio Equilíbrios heterogêneos Aplicações das constantes de equilíbrio Princípio de Le Châtelier Exemplos de equilíbrios Conceito de Equilíbrio Uma reação química pode atingir um estado no qual o processo direto e inverso ocorrem à mesma velocidade. Essa condição é chamada equilíbrio químico e resulta da formação de uma mistura no equilíbrio de reagentes e produtos da reação. A composição de uma mistura no equilíbrio não varia com o tempo. Ao expressarmos as concentrações relativas dos reagentes e produtos presentes nas misturas no equilíbrio, usaremos para os gases pressões parciais e, para os solutos usaremos as concentrações em quantidade de matéria. No equilíbrio, para indicar que a reação prossegue tanto no sentido direto quanto no inverso, usamos a seta dupla: O Processo de Haber O processo de Haber (também conhecido como Processo Haber-Bosch) é uma reação entre nitrogênio e hidrogênio para produzir amônia. Esta reação é catalisada por ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450ºC: O processo foi desenvolvido por Fritz Haber e Carl Bosch em 1909. Foi usado pela primeira vez em escala industrial, na Alemanha, durante a I Guerra Mundial, para a fabricação de munição através da amônia produzida, que era oxidada para a forma de ácido nítrico e este utilizado para a confecção de explosivos de nitrogênio. Mais tarde esse processo possibilitou também aos cientistas sintetizar fertilizantes, o que aumentou a produção de grãos e salvou milhões de pessoas da inanição. A Constante de Equilíbrio A relação entre as concentrações dos reagentes e produtos de um sistema em equilíbrio é dada pela Lei da Ação das Massas. Para uma equação de equilíbrio geral da forma aA + bB cC + dD a expressão da constante de equilíbrio é escrita como segue: Keq = [C]c x [D]d para um equilíbrio aquoso ou [A]a x [B]b Keq= (Pc)c x (Pd)d (Pa)a x (Pb)b para um equilíbrio na fase gasosa Pela equação dos gases perfeitos tem-se : onde Px é a pressão parcial de um gás x qualquer,V é o volume ocupado pela mistura, nx é a quantidade de matéria do gás, R é a constante dos gases perfeitos, e T a temperatura em kelvin. Rearranjando a equação, temos: (nx/V) é concentração molar do gás. A constante R é sempre a mesma e a temperatura T não varia em um sistema que permanece em equilíbrio químico, assim o único fator que pode variar na equação em um equilíbrio é a pressão parcial Px. Dessa forma a concentração do gás é proporcional à sua pressão parcial. Por exemplo: • Ordem de grandeza das constantes de equilíbrio Keq = [C]c x [D]d [A]a x [B]b Quando Keq > 1 : o equilíbrio encontra-se à direita; predominam os produtos. Quando Keq < 1 : o equilíbrio encontra-se à esquerda; predominam os reagentes. Equilíbrios Heterogêneos Os equilíbrios em que todas as substâncias estão na mesma fase são chamados equilíbrios homogêneos; nos equilíbrios heterogêneos duas ou mais fases estão presentes. Como as concentrações de sólidos e líquidos puros são constantes, essas substâncias são deixadas de fora da expressão da constante de equilíbrio para um equilíbrio heterogêneo. Aplicações das Constantes de Equilíbrio Q = (conc. inicial C) c x (conc. inicial D) d (conc. inicial A)a x (conc. inicial B) b Q = quociente da concentração inicial O quociente da reação será igual à constante de equilíbrio apenas se o sistema estiver em equilíbrio: Q = Keq . Se Q > Keq as substâncias do lado direito da equação reagirão para formar as substâncias da esquerda. Se Q < Keq as substâncias do lado esquerdo da equação reagirão para formar as substâncias da direita. Princípio de Le Châtelier Ao exercer uma ação sobre um sistema em equilíbrio, o mesmo reagirá de modo a minimizar o efeito da ação. • Variação nas concentrações de reagentes ou produtos Se um sistema químico está em equilíbrio e adicionamos uma substância (um reagente ou um produto), a reação se deslocará de tal forma a restabelecer o equilíbrio pelo consumo de parte da substância adicionada. Contrariamente, a remoção de uma substância fará com que a reação se mova no sentido de formar mais daquela substância. Exemplo: Adição de H2 : a reação se deslocará em direção à formação de mais NH3 • Variações de volume e pressão À temperatura constante, a redução do volume de uma mistura gasosa no equilíbrio faz com que o sistema se desloque no sentido de reduzir o número de moléculas de gás. Contrariamente o aumento do volume causa um deslocamento no sentido de produzir mais moléculas de gás. N2O4 (g) 2 NO2 (g) • Variações de temperatura Quase toda constante de equilíbrio varia seu valor à medida que a temperatura varia. Para deduzir as regras de dependência da constante de equilíbrio com a temperatura aplicando o princípio Le Châtelier, devemos tratar o calor como se ele fosse um reagente químico. Endotérmica: Reagentes + CALOR Kp aumenta Exotérmica: Reagentes Kp diminui Produtos Produtos + CALOR • Efeito do Catalisador Um catalisador aumenta a velocidade na qual o equilíbrio é atingido, mas não a composição da mistura no equilíbrio. O valor da constante de equilíbrio para uma reação não é afetado pela presença de um catalisador. Exemplos de Equilíbrios Óculos fotocromáticos: São aqueles óculos que possuem lentes que mudam de cor conforme a intensidade luminosa. Isto se deve à seguinte reação química em equilíbrio: AgCl + energia Ag + Cl O cloreto de prata (AgCl), quando na lente, dá uma aparência clara para a mesma, já a prata metálica (Ag), quando é formada na lente dá uma aparência escura à lente. Refrigerante: Dentro de uma garrafa de refrigerante ocorrem inúmeras reações químicas. Para este capítulo temos a seguinte reação: H2CO3(aq) H2O + CO2(g) Esta é uma reação que representa um estado de equilíbrio, que sofre influência pelo aumento de temperatura, pela pressão e também pela concentração. Quando abrimos a garrafa de um refrigerante, estamos diminuindo a pressão e deslocando o equilíbrio para a direita, o que resulta na liberação de gás. Referências Bibliográficas - Química: A Ciência Central, 9ª ed. Brown, LeMay, Bursten - http://pt.wikipedia.org/wiki/Equilíbrio_químico - http://www.quiprocura.net/equilibrio.htm
Download